उष्मागतिकी
| विज्ञान |
|---|
|
रूपरेखा · प्रवेशद्वार · श्रेणी |
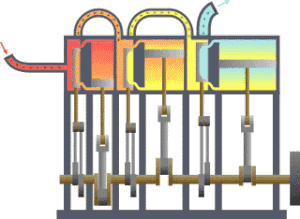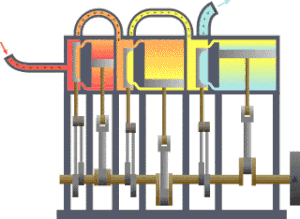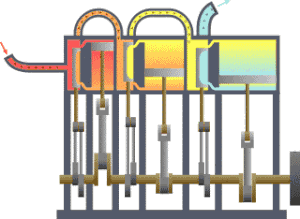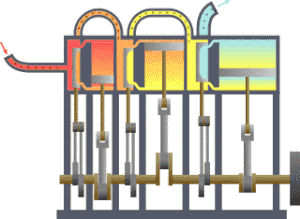
भौतिकी में उष्मागतिकी (उष्मा + गतिकी = उष्मा की गति संबंधी या ऊष्मा और गति) के अन्तर्गत ऊर्जा का कार्य और उष्मा में रूपान्तरण, तथा इसका तापमान और दाब जैसे स्थूल चरों से सम्बन्ध का अध्ययन किया जाता है। इसमें ताप, दाब तथा आयतन का सम्बन्ध भी समझा जाता है।
कार्यक्षेत्र
उष्मागतिकी— में उष्मागतिकी विज्ञान की वह शाखा थी जिसमें केवल उष्मा के कार्य में परिणत होने अथवा कार्य के उष्मा में परिणत होने का विवेचन किया जाता था। परन्तु अब इसका क्षेत्र अधिक विस्तृत हो गया है। अब इसमें ताप संबंधी लगभग सभी बातों का अध्ययन किया जाता है। उदाहरणतः यदि हम निकल जैसे किसी चुम्बकीय पदार्थ की एक छड़ को एक कुण्डली के भीतर रखें और इस कुण्डली में बिजली की धारा प्रवाहित कराकर एक चुंबकीय क्षेत्र स्थापित करें तो छड़ की लम्बाई में थोड़ा अन्तर आ जाएगा, वह थोड़ा गर्म हो जाएगा और उसकी विशिष्ट उष्मा में भी अन्तर हो जाएगा। ऐसे ही यदि नाइट्रोजन तथा हाइड्रोजन का मिश्रण लेकर हम उसमें एक उत्प्रेरक छोड़ दें तो इस मिश्रण में नाइट्रोजन, हाइड्रोजन तथा अमोनिया एक विशेष अनुपात में रहेंगे। ताप में परिवर्तन होने से इस अनुपात में भी परिवर्तन होता है और यह परिवर्तन उस उष्मा से सम्बन्धित है जो अमोनिया के संश्लेषण की क्रिया में ताप को अपरिवर्तित रखने के लिए उस मिश्रण से निकालनी आवश्यक होती है। ऐसी ही अन्य बातों का अध्ययन भी अब उष्मागतिकी के अन्तर्गत होता है जिससे इसका क्षेत्र बहुत विस्तृत हो गया है।
उष्मागतिकी के सिद्धान्त
स्क्रिप्ट त्रुटि: "main" ऐसा कोई मॉड्यूल नहीं है।
19वीं शताब्दी के मध्य में उष्मागतिकी के दो सिद्धान्तों का प्रतिपादन किया गया था, जिन्हें उष्मागतिकी के प्रथम एवं द्वितीय सिद्धान्त कहते हैं। 20वीं शताब्दी के प्रारम्भ में दो अन्य सिद्धांतों का प्रतिपादन किया गया है जिन्हें उष्मागतिकी का शून्यवाँ तथा तृतीय सिद्धान्त कहते हैं।
जूल के प्रयोगों ने यह सिद्ध किया कि उष्मा, ऊर्जा का ही एक रूप है और वह अपनी मात्रा के अनुपात में ही काम कर सकती है। इसी को उष्मागति का प्रथम नियम कहते हैं। इसके अनुसार बिना लगातार ईंधन जलाए किसी उष्मिक इंजन से निरन्तर काम नहीं लिया जा सकता। किन्तु उष्मा की मात्रा तो चारों ओर अनन्त है और इसलिए यह सम्भावना हो सकती है कि हम चारों ओर के पदार्थों की उष्मा निकालकर उसको काम में परिवर्तित करते रहें और इस प्रकार बिना व्यय के इंजन चला सकें। अनुभव यह बतलाया है कि ऐसा होना संभव नहीं और यही दूसरे नियम का विषय है।
यह नियम उन परिवर्तनों पर लागू होता है जिनमें एक चक्र (साइकिल) के उपरान्त समुदाय पुनः अपने मूल रूप में आ जाता है। इसका यह अर्थ है कि हम केवल ऐसे परिवर्तनों पर विचार करेंगे जिनमें उष्मा कर्म में परिवर्तित होती है और इसके अतिरिक्त कोई अन्य परिवर्तन नहीं होता। इस नियम के अनुसार यदि कोई पदार्थ और उसके परिपार्श्व (surroundings) सब एक ही ताप पर हों तो उनकी उष्मा को काम में नहीं बदला जा सकता। ऐसा करने के लिए कम से कम दो भिन्न तापवाले पदार्थों की आवश्यकता होती है और उनसे ताप के अंतर के कारण ही काम करने के लिए उष्मा प्राप्त हो सकती है। इस नियम के मूल में यह तथ्य है कि अणुओं की उष्मिक गति अनियमित होती है और इंजन के पिस्टन की सुनियमित। जैसे ताश के पत्तों को बारंबार फेंटकर उनका नियमित विन्यास करना असंभव सा ही है, ऐसे ही अणुओं की अनियमित उष्मिक गति का भी स्वत: पिस्टन की नियमित गति में परिवर्तित होना अतिदुष्कर है। इंजन जो भी उष्मा काम में परिवर्तित करते हैं उसका कारण यह है कि इसके साथ ही साथ उनमें कर्म करनेवाले पदार्थ कुछ उष्मा भट्ठी से संघनित्र (कंडेन्सर) में स्थानांतरित कर देते हैं। इस कारण इसकी आणविक गति की अनियमितता बढ़ जाती है और कुल समुदाय की अनियमितता का ह्रास नहीं होता।
आचार्यों ने उष्मागतिकी के दूसरे नियम के अनेक रूप दिए हैं जो मूलतः एक ही हैं, जैसे :
- ऐसे उष्मिक इंजन का निर्माण करना संभव नहीं जो पूरे चक्र में काम करते हुए केवल एक ही पिंड से उष्मा ग्रहण करे और काम करनेवाले समुदाय में बिना परिवर्तन लाए उस संपूर्ण उष्मा को काम में बदल दे (प्लांक-केल्विन)।
- बिना बाहरी सहायता के कोई भी स्वतः काम करनेवाली मशीन उष्मा को निम्नतापीय पिण्ड से उच्चतापीय पिण्ड में नहीं ले जा सकती, अर्थात् उष्मा ठंडे पिण्ड से गरम में स्वतः नहीं जा सकती (क्लाज़िउस)।
कार्नो ने, जो उष्मा के असली स्वरूप से अनभिज्ञ था, एक आदर्श इंजन की कल्पना करके उसकी दक्षता (एफ़िशेन्सी) की गणना की। इसका इंजन पूर्णरूपेण उत्क्रमणीय (रिवर्सिबिल) है। इसका यह अभिप्राय है कि किसी समुदाय की कार्यप्रणाली उलट देने पर उसके समस्त कार्यों की दिशा भी उलट जाती है, अर्थात् यदि सीधी विधि में उष्मा शोषित होती है तो विपरीत विधि में उतनी ही मात्रा उत्सर्जित होगी और यदि सीधी विधि में उत्सर्जित हुई तो विपरीत विधि में उतनी ही शोषित होती है। उत्क्रमणीय परिवर्तन वे ही होते हैं जिनमें निरन्तर साम्यावस्था (ईक्विलिब्रियम) रहती है।
जिन परिवर्तनों में बाहरी उष्मा का आवागमन नहीं होता उनको रुद्धोष्म (ऐडियाबैटिक) कहते हैं। इनके कारण यदि आयतन में वृद्धि होती है तो दाब के विपरीत काम करने के कारण समुदाय ठंडा हो जाता है और इसके विपरीत आयतन में कमी होने से समुदाय गरम हो जाता है। यदि बाहरी उष्मा के सम्पर्क से समुदाय का ताप स्थिर रहे तो परिवर्तन को समतापीय (आइसोथर्मल) कहते हैं।
कार्नो ने सिद्ध किया कि किसी भी इंजन की दक्षता उत्क्रमणीय इंजन से अधिक नहीं हो सकती और सिलिंडर के भीतर कोई भी पदार्थ क्यों न काम करे, समस्त उत्क्रमणीय इंजनों की दक्षता एक ही होती है। इसी को कार्नो प्रमेय कहते हैं। कार्नो के प्रमाण का आधार यह है कि यदि कोई अन्य इंजन उत्क्रमणीय इंजन से अधिक दक्ष हो तो इन दोनों को उचित रूप से जोड़कर कम तापवाले संघनित्र से बिना अन्य परिवर्तन किए उष्मा निकालकर काम कराना संभव हो सकता है। यह उष्मागतिकी के द्वितीय नियम के अनुसार संभव नहीं।
इतिहास

इन्हें भी देखें
सन्दर्भ
- ↑ Schools of thermodynamics स्क्रिप्ट त्रुटि: "webarchive" ऐसा कोई मॉड्यूल नहीं है। – EoHT.info.
सन्दर्भ ग्रन्थ
- गुगेनहाइम : थर्मोडाइनैमिक्स;
- विल्सन : थर्मोडाइनैमिक्स ऐंड स्टैटिस्टिकल मिकैनिक्स;
- सोमरफ़ेल्ड : थर्मोडाइनैमिक्स ऐंड स्टैटिस्टिकल मिकैनिक्ल मिकैनिक्स;
- फर्मी : थर्मोडाइनैमिक्स।