एचआइवी
इस लेख से या तो उद्धरण अनुपस्थित हैं या उनके स्रोतों की आवश्यकता है। कृपया उद्धरण जोड़कर कॉपीराइट उल्लंघन और तथ्यात्मक त्रुटियों से लेख की रक्षा करें। |
| Human immunodeficiency virus | |
|---|---|
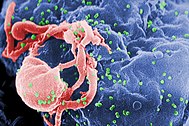
| |
| Scanning electron micrograph of HIV-1 (in green) budding from cultured lymphocyte. Multiple round bumps on cell surface represent sites of assembly and budding of virions. | |
| Virus classification | |
| Species | |
|
ह्युमन इम्युनोडेफिशिएंसी वायरस (Human immunodeficiency virus) (एचआईवी) (HIV) एक लेंटिवायरस (रेट्रोवायरस परिवार का एक सदस्य) है, जो अक्वायर्ड इम्युनोडेफिशिएंसी सिंड्रोम (acquired immunodeficiency syndrome) (एड्स) (AIDS) का कारण बनता है,[१][२] जो कि मनुष्यों में एक अवस्था है, जिसमें प्रतिरक्षा तंत्र विफल होने लगता है और इसके परिणामस्वरूप ऐसे अवसरवादी संक्रमण हो जाते हैं, जिनसे मृत्यु का खतरा होता है। एचआईवी (HIV) का संक्रमण रक्त के अंतरण, वीर्य, योनिक-द्रव, स्खलन-पूर्व द्रव या मां के दूध से होता है। इन शारीरिक द्रवों में, एचआईवी (HIV) मुक्त जीवाणु कणों और प्रतिरक्षा कोशिकाओं के भीतर उपस्थित जीवाणु, दोनों के रूप में उपस्थित होता है। इसके संचरण के चार मुख्य मार्ग असुरक्षित यौन-संबंध, संक्रमित सुई, मां का दूध और किसी संक्रमित मां से उसके बच्चे को जन्म के समय होने वाला संचरण (ऊर्ध्व संचरण) हैं। एचआईवी (HIV) की उपस्थिति का पता लगाने के लिये रक्त-उत्पादों की जांच करने के कारण रक्ताधान अथवा संक्रमित रक्त-उत्पादों के माध्यम से होने वाला संचरण विकसित विश्व में बड़े पैमाने पर कम हो गया है।
एचआईवी (ह्युमन इम्युनडिफिशिएंशी वायरस) या मानवीय प्रतिरक्षी अपूर्णता विषाणु [मा.प्र.अ.स.] एक विषाणु है जो शरीर की रोग-प्रतिरक्षा प्रणाली पर प्रहार करता है और संक्रमणों के प्रति उसकी प्रतिरोध क्षमता को धीरे-धीरे कम करता जाता है। यह लाइलाज बीमारी एड्स का कारण है। मुख्यतः यौण संबंध तथा रक्त के जरिए फैलने वाला यह विषाणु शरीर की श्वेत रक्त कणिकाओं का भक्षण कर लेता है। इसमें उच्च आनुवंशिक परिवर्तनशीलता का गुण है। यह विशेषता इसके उपचार में बहुत बड़ी बाधा उत्पन्न करता है।[३]
मनुष्यों में होने वाले एचआईवी (HIV) संक्रमण को विश्व स्वास्थ्य संगठन (World Health Organization) (डब्ल्यूएचओ)(WHO) द्वारा महामारी माना गया है। इसके बावजूद, एचआईवी (HIV) के बारे में व्याप्त परितोष एचआईवी (HIV) के जोखिम में एक मुख्य भूमिका निभा सकता है।[४][५] 1981 में इसकी खोज से लेकर 2006 तक, एड्स (AIDS) 25 मिलियन से अधिक लोगों की जान ले चुका है।[६] विश्व की लगभग 0.6% जनसंख्या एचआईवी (HIV) से संक्रमित है।[६] एक अनुमान के मुताबिक केवल 2005 में ही, एड्स (AIDS) ने लगभग 2.4–3.3 मिलियन लोगों की जान ले ली, जिनमें 570,000 से अधिक बच्चे थे। इनमें से एक-तिहाई मौतें उप-सहाराई अफ्रीका में हुईं, जिससे आर्थिक विकास की गति धीमी पड़ गई और गरीबी में वृद्धि हुई। [७] वर्तमान अनुमानों के अनुसार, एचआईवी (HIV) अफ्रीका में 90 मिलियन लोगों को संक्रमित करने को तैयार है, जिसके चलते अनुमानित रूप से कम से कम 18 मिलियन लोग अनाथ हो जाएंगे.[८] एंटीरेट्रोवायरल उपचार एचआईवी (HIV) की मृत्यु-दर और रुग्णता-दर दोनों को कम करता है, लेकिन सभी देशों में एंटिरेट्रोवायरल दवाओं तक नियमित पहुंच उपलब्ध नहीं है।[९]
प्राथमिक रूप से एचआईवी (HIV) मानवीय प्रतिरोधक प्रणाली की आवश्यक कोशिकाओं, जैसे सहायक टी-कोशिकाएं (helper T cells) (विशिष्ट रूप से, सीडी4+ टी कोशिकाएं), मैक्रोफेज और डेंड्राइटिक कोशिका को संक्रमित करता है।[१०] एचआईवी (HIV) संक्रमण के परिणामस्वरूप सीडी4+ टी (CD4+ T) के स्तरों में कमी आने की तीन मुख्य कार्यविधियां हैं: सबसे पहले, संक्रमित कोशिकाओं की प्रत्यक्ष जीवाण्विक समाप्ति; दूसरी, संक्रमित कोशिका में एपोप्टॉसिस की बढ़ी हुई दर; और तीसरी संक्रमित कोशिका की पहचान करने वाले सीडी8 (CD8) साइटोटॉक्सिक लिम्फोसाइट द्वारा संक्रमित सीडी4+ टी कोशिकाओं (CD4+ T cells) की समाप्ति. जब सीडी4+ टी (CD4+ T) कोशिकाओं की संख्या एक आवश्यक स्तर से नीचे गिर जाती है, तो कोशिका की मध्यस्थता से होने वाली प्रतिरक्षा समाप्त हो जाता है और शरीर के अवसरवादी संक्रमणों से ग्रस्त होने की संभावना बढ़ने लगती है।
एचआईवी-1 (HIV-1) के द्वारा संक्रमित अधिकांश अनुपचारित लोगों में अंततः एड्स (AIDS) विकसित हो जाता है।[११] इनमें से अधिकांश लोगों की मौत अवसरवादी संक्रमणों से या प्रतिरोध तंत्र की बढ़ती विफलता से जुड़ी असाध्यताओं के कारण होती है।[१२] एचआईवी (HIV) का एड्स (AIDS) में विकास होने की दर भिन्न-भिन्न होती है और इस पर जीवाण्विक, मेज़बान और वातावरणीय कारकों का प्रभाव पड़ता है; अधिकांश लोगों में एचआईवी (HIV) संक्रमण के 10 वर्षों के भीतर एड्स (AIDS) विकसित हो जाएगा: कुछ लोगों में यह बहुत ही शीघ्र होगा और कुछ लोग बहुत अधिक लंबा समय लेंगे.[१३][१४] एंटी-रेट्रोवायरल के द्वारा उपचार किये जाने पर एचआईवी (HIV) संक्रमित लोगों के जीवित रहने की संभावना बढ़ जाती है। 2005 तक की जानकारी के अनुसार, निदान किये जा सकने योग्य एड्स (AIDS) के रूप में एचआईवी (HIV) का विकास हो जाने के बाद भी एंटीरेट्रोवायरल उपचार के बाद व्यक्ति का औसत उत्तरजीविता-काल 5 वर्षों से अधिक होता है।[१५] एंटीरेट्रोवायरल उपचार के बिना, एड्स (AIDS) से ग्रस्त किसी व्यक्ति की मृत्यु विशिष्ट रूप से एक वर्ष की भीतर ही हो जाती है।[१६]
प्रमुख प्रकार
इसके दो प्रमुख प्रकारहैं- एचआईवी -1 और एचआईवी 2। एचआईवी -1 चिम्पांजी और पश्चिमी अफ्रीका में रहने वाले गोरिला में पाए जानेवाले विषाणु हैं, जबकि एचआईवी -2 साँवले मंगबेयों में पाए जाने वाले विषाणु हैं।[१७] एचआईवी -1 को और समूहों में विभाजित किया जा सकता है। एचआईवी -1 एम ग्रुप विषाणु प्रबल होता है और एड्स के लिए जिम्मेदार है। आनुवंशिक अनुक्रम ब्यौरे के हिसाब से ग्रुप एम और कई रूपों में उब्विभाजित हो सकता है। उपप्रकारों में से कुछ अधिक उग्र होते हैं या अलग दवाओं से प्रतिरोधी रहे हैं। इसी तरह, एचआईवी - 2 वायरस कम उग्र और एचआईवी -1 कम संक्रामक माना गया है, हालांकि 2 एचआईवी 2 भी एड्स का कारण माना गया है।
एचआईवी -1
एचआईवी -1 विषाणु आम और सर्वाधिक रोगजनक है। इसे (समूह एम) और दो या दो से अधिक साधारण समूहों में रखा जाता है। प्रत्येक समूह के बारे में माना जाता है कि वह मानव जाती में एचआइवी के स्वतंत्र प्रसार (एक ग्रुप के भीतर उपप्रकार को छोड़कर) का प्रतिनिधित्व करते हैं।[१७]
समूह एम
यह एचआइवी-१ की तरह आम तौर पर पाया जाने वाला प्रकार नहीं है। यह एचाइवी-१ के पुनर्संयोजन से विकसित रूप है।
समूह एन
'एन' का मतलब "गैर - एम, गैर - ओ" समूह से है। इस समूह की खोज १९९८ में हुई और यह केवल कैमरून में ही पाया गया है। २00६ ई. तक ग्रुप एन के केवल १0 संक्रमण पाए गए हैं।
समूह ओ
ओ समूह आम तौर पर पश्चिम - मध्य अफ्रीका के बाहर नहीं देखा गया है। यह कैमरून में सबसे आम है। १९९७ई. में वहाँ किए गए एक सर्वेक्षण में एचआईवी धनात्मक नमूनों में लगभग 2% समूह ओ समूह से सम्बंधित पाए गए थे। इस समूह से संबंधित विषाणु एचआईवी -1 परीक्षण की प्रारंभिक प्रक्रिया के द्वारा चिन्हित नहीं किए जा सकते हैं। हालाँकि अधिक विकसित एचआईवी परीक्षण द्वारा अब ओ और एन दोनों समूहों के विषाणुओं का पता लगाया जा सकता है।
समूह पी
२00९ई. में, एक नए प्रकार की एचआइवी पाई गयी जो लगभग उसी समय जंगली गोरिलों में पाए गए एचआइवी विषाणु के समान था। यह चिंपांजियों में पाए जाने वाले एचआइवी से भिन्न था। यह विषाणु केवल फ्रांस में रहनेवाली कैमरूनी महिला में २00४ ई. में एचआईवी -1 संक्रमण के तौर पर पाया गया था।
एचआईवी -२
एचआईवी -२ अफ्रीका के बाहर व्यापक रूप से नहीं देखा गया है। संयुक्त राज्य अमेरिका में यह विषाणु पहली बार १९८७ में पाया गया था। २0१0 ई. तक एचआईवी -2 (के समूह ए से एच) तक से संबंधित कुल ८ मामले सामने आए हैं। इनमे से केवल ए और बी महामारी हैं। एचआईवी-२ मुख्यतः पश्चिम अफ्रीका से फैला है। इस के छह उपप्रकार हैं जिनके कम-से-कम एक एक व्यक्तियों में पाए जाने की पुष्टि हो चुकी है।
प्रसार क्षेत्र
एचआइवी-१ का उपप्रकार ए पश्चिम अफ्रीका में आम है[१८].
- उपप्रकार बी यूरोप, अमेरिका, जापान, थाईलैंड और ऑस्ट्रेलिया में प्रमुख रूप है[१९]।
- उपप्रकार सी दक्षिणी अफ्रीका, भारत और नेपाल में प्रमुख रूप है[१९]।
- आम तौर पर केवल उपप्रकार डी से पूर्वी और मध्य अफ्रीका में देखी गयी है[१९]।
- (उप ई) न घुल-मिल पानेवाले रूप में केवल CRF01_AE के रूप में उप प्रकार एक साथ दोबारा मिलादी गयी है[१९]।
- उपप्रकार एफ मध्य अफ्रीका, दक्षिण अमेरिका और पूर्वी यूरोप में है।
- उपप्रकार जी (और CRF02_AG) अफ्रीका और मध्य यूरोप में है।
- उपप्रकार एच केंद्रीय अफ्रीका तक ही सीमित है।
- (उपप्रकार आई) मूल रूप से है कि अब CRF04_cpx के रूप के लिए जिम्मेदार है कई उपप्रकारों में से एक "जटिल" है।
- उपप्रकार जे मुख्य रूप से उत्तर, मध्य और पश्चिम अफ्रीका में और कैरिबियन में है।
- उपप्रकार के लोकतांत्रिक गणराज्य कांगो और कैमरून तक सीमित है।
इन उपप्रकारों कभी कभी और भी विभाजन जैसे A1 और A2 या F1 और F2 उप-उपप्रकारों में विभाजित किया जाता है। यह एक पूर्ण या अंतिम सूची के रूप में नहीं है और आगे प्रकार के पाए जाने की संभावना है[२०]।
एचआइवी-२ का समूह ए मुख्य रूप से पश्चिम अफ्रीका में फैले होने के साथ ही अंगोला, मोजाम्बिक, ब्राजील, भारत और बहुत सिमित रूप से यूरोप तथा अमेरिका में भी पाया गया है। समूह बी मुख्य रूप से पश्चिम अफ्रीका तक ही सीमित है।
उपचार
एचआईवी अभी तक एक लाइलाज बीमारी मानी जाती है।[२१] शोध चल रहे हैं, हालांकि अभी तक पूर्णतः इलाज विकसित कर पाने में सफलता नहीं मिल पायी है। वर्तमान में बाजार कुछ उपचार एचआईवी रोगियों के लिए उपलब्ध हैं जो आंशिक रूप से उनकी पीड़ा को कम करने तथा उनके जीवन को स्वस्थ, उत्पादक और दीर्घ करने में सहायक हो सकते हैं।
आयुर्वेदिक
एचआइवी के दुष्प्रभाव को कम करने वाली एवं रोग प्रतिरोधक क्षमता तंत्र को मजबूत करने वाली अनेक औषधियाँ हैं। ये एचआईवी विषाणु को मिटा तो नहीं सकती हैं लेकिन उसके मरीज को अधीक लंबी अवधी तक जीवित रखने में सहायक हैं।
वर्गीकरण
एचआईवी (HIV) लेंटिवायरस (Lentivirus) श्रेणी,[२२] जो कि रेट्रोवायरिडी (Retroviridae) परिवार का एक भाग है, का एक सदस्य है।[२३] लेंटिवायरसों की अनेक सामान्य शब्द संरचनाएं व जैविक विशेषताएं हैं। अनेक प्रजातियां लेंटिवायरसों द्वारा संक्रमित हैं, जो विशेष रूप से लंबी-अवधि की ऐसी बीमारियों के लिये जिम्मेदार होते हैं, जिनका उष्मायन काल लंबा होता है।[२४] लेंटिवायरस एकल-तंतु, सकारात्मक-दिशा व आवरण युक्त आरएनए (RNA) जीवाणुओं के रूप में संचरित होते हैं। लक्ष्य कोशिका में प्रवेश करने पर, जीवाण्विक आरएनए (RNA) जीनोम को जीवाणु कण में मौजूद एक जीवाण्विक रूप से कूटबद्ध रिवर्स ट्रांस्क्रिप्टेस के द्वारा दोहरे-तंतु युक्त डीएनए (DNA) में रूपांतरित कर दिया जाता है। इसके बाद यह जीवाण्विक डीएनए (DNA) एक जीवाण्विक रूप से कूटबद्ध इंटीग्रेस के द्वारा मेजबान कोशिका के सह-कारकों के साथ एक कोशिकीय डीएनए (DNA) में एकीकृत किया जाता है,[२५] ताकि इस जीनोम की प्रतिलिपि बनाई जा सके। एक बार जब यह जीवाणु कोशिका को संक्रमित कर देता है, तो दो परिणाम हो सकते हैं: या तो जीवाणु अदृश्य हो जाता है और संक्रमित कोशिका अपना कार्य करना जारी रखती है, या फिर जीवाणु सक्रिय हो जाता है और प्रतिलिपित होता जाता है और तब जीवाणु कणों की एक बड़ी संख्या अन्य मुक्त कोशिकाओं को संक्रमित कर सकती है।
एचआईवी (HIV) की दो प्रजातियां ज्ञात हैं: एचआईवी-1 (HIV-1) और एचआईवी (HIV-2). एचआईवी-1 (HIV-1) वह वायरस है, जिसे प्रारंभ में खोजा गया था और एलएवी (LAV) और एचटीएलवी-III (HTLV-III) दोनों के रूप में चिह्नित किया गया था। यह अधिक उग्र, अधिक संक्रामक है और यह पूरे विश्व में एचआईवी (HIV) अधिकांश संक्रमणों का कारण है।[२६] एचआईवी-1 (HIV-1) की तुलना में एचआईवी-2 (HIV-2) की संक्रामकता कम होने का अर्थ यह है कि एचआईवी-2 (HIV-2) संपर्क में आने वाले लोगों में संक्रमण की प्रति संपर्क दर अपेक्षाकृत कम होगी। इसकी अपेक्षाकृत कमज़ोर संचरण क्षमता के कारण एचआईवी-2 (HIV-2) बड़े पैमाने पर पश्चिम अफ्रीका तक ही सीमित है।[२७]
| प्रजाति | उग्रता | संक्रामकता | प्रसार | अनुमानित मूल |
|---|---|---|---|---|
| एचआईवी-1 (HIV-1) | उच्च | उच्च | वैश्विक | आम चिंपांज़ी |
| एचआईवी-2 (HIV-2) | निम्न | निम्न | पश्चिमी अफ्रीका | सूटी मैंगेबी |
संकेत व लक्षण
एचआईवी-1 (HIV-1) से होने वाले संक्रमण को सीडीटी+4 टी (CD4+ T) कोशिकाओं की संख्या में लगातार आती गिरावट और जीवाण्विक भार में वृद्धि से जोड़ा जाता है। संक्रमण के चरण का निर्धारण मरीज की सीडीटी+4 टी (CD4+ T) कोशिकाओं की संख्या और रक्त में एचआईवी (HIV) के स्तर से किया जा सकता है।
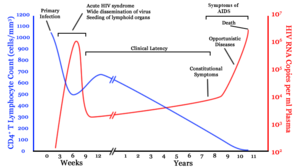
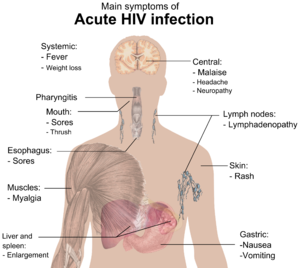
मूलतः एचआईवी (HIV) संक्रमण के चार चरण होते हैं: उष्मायन काल, तीव्र संक्रमण, विलंब चरण और एड्स (AIDS). संक्रमण के बाद के प्रारंभिक उष्मायन काल लक्षणविहीन होता है और इसकी अवधि सामान्यतः दो से चार सप्ताहों तक होती है। दूसरा चरण, तीव्र संक्रमण, औसतन 28 दिनों तक चलता है और इसमें बुखार, लिंफैडेनोपैथी (lymphadenopathy) (लसिका ग्रंथि में सूजन), फैरिंजाइटिस (pharyngitis) (गले में खराश), फुंसी, पेशीशूल (मांसपेशियों में दर्द), बेचैनी और मुंह तथा भोजन-नली में घाव जैसे लक्षण शामिल हो सकते हैं।
विलंबता चरण, जो कि तीसरा चरण है, में या तो बहुत थोड़े लक्षण प्रदर्शित होते हैं या कोई लक्षण दिखाई नहीं देता और यह चरण दो सप्ताहों से लेकर बीस वर्षों या उससे भी अधिक समय तक चल सकता है। एचआईवी (HIV) संक्रमण का चौथा और अंतिम चरण एड्स (AIDS) विभिन्न अवसरवादी संक्रमणों के लक्षणों जैसे ही लक्षण प्रदर्शित करता है।
फ्रांसीसी अस्पताल के मरीज़ों के अध्ययन में यह पाया गया कि एचआईवी-1 (HIV-1) से संक्रमित व्यक्तियों में से लगभग 0.5% व्यक्ति किसी एंटी-रेट्रोवायरल उपचार के बिना भी सीडीआर4 टी-कोशिकाओं (CD4 T-cells) के उच्च स्तर और एक निम्न अथवा चिकित्सीय रूप से न पहचाना जा सकने वाला जीवाण्विक भार बनाए रखते हैं। इन व्यक्तियों को एचआईवी (HIV) नियंत्रकों या लंबी-अवधि के गैरविकासकों के रूप में वर्गीकृत किया जाता है।[२८]
एचआईवी (HIV) का तीव्र संक्रमण
सामान्यतः एचआईवी (HIV) के साथ प्रारंभिक संक्रमण एक संक्रमित व्यक्ति से किसी असंक्रमित व्यक्ति में शारीरिक द्रवों के स्थानांतरण के साथ होता है। संक्रमण का पहला चरण, प्राथमिक या तीव्र संक्रमण, तीव्र जीवाण्विक प्रतिलिपि निर्माण का चरण है, जो किसी व्यक्ति के एचआईवी (HIV) के संपर्क में आने के तुरंत बाद आता है, जिसके परिणामस्वरूप परिधीय रक्त में जीवाणुओं की अधिकता हो जाती है और एचआईवी (HIV) के स्तर आम तौर पर अनेक मिलियन जीवाणु प्रति मिली (mL) तक पहुंच जाते हैं।[२९]
इस प्रतिक्रिया के साथ ही गश्ती सीडी4+ टी (CD4+ T) कोशिकाओं की संख्या में भी उल्लेखनीय गिरावट देखी जाती है। लगभग सभी मरीजों में रक्त में जीवाणुओं की यह तीव्र उपस्थिति सीडी8+ टी कोशिकाओं (CD8+ T Cells), जो एचआईवी (HIV) संक्रमित कोशिकाओं को नष्ट करती हैं, के सक्रियण और इसके बाद प्रतिरक्षी के निर्माण या सीरोकन्वर्जन (seroconversion) से जुड़ी होती है। ऐसा माना जाता है कि सीडी8+ टी (CD8+ T) कोशिकाओं की प्रतिक्रिया जीवाणुओं के स्तरों को नियंत्रित करने में महत्वपूर्ण है, जो कि पहले बढ़ते हैं lऔर फिर सीडी4+ टी (CD4+ T) कोशिकाओं की वापसी के साथ ही पुनः घट जाते हैं। सीडी8+ टी (CD8+ T) कोशिकाओं की एक अच्छी प्रतिक्रिया को बीमारी के विकास की गति में कमी और एक बेहतर रोगनिदान से जोड़ा जाता रहा है, हालांकि यह जीवाणु को खत्म नहीं करती.[३०]
इस अवधि के दौरान (सामान्यतः संपर्क के 2–4 सप्ताहों बाद) अधिकांश (80 से 90%) व्यक्तियों में इंफ्लुएंज़ा या मोनोन्यूक्लिऑसिस (mononucleosis)-जैसी कोई बीमारी विकसित हो जाती है, जिसे तीव्र एचआईवी (HIV) संक्रमण कहते हैं और इसके सबसे आम लक्षणों में बुखार, लिंफैडेनोपैथी, फैरिंजाइटिस, फुंसी, पेशीशूल, मुंह और भोजन नली में घाव आदि लक्षण शामिल हो सकते हैं और इनके अलावा इसमें सिरदर्द, मिचली और उल्टी, यकृत/प्लीहा के आकार में वृद्धि, भार में कमी, छाले और तंत्रिका संबंधी लक्षण भी शामिल हो सकते हैं, आमतौर पर कम ही मिलते हैं। संक्रमित व्यक्तियों में इनमें से सभी या कुछ लक्षण देखे जा सकते हैं या इनमें से सभी लक्षण अनुपस्थित भी हो सकते हैं। लक्षणों की अवधि में अंतर होता है और औसतन यह 28 दिनों तक तथा सामान्यतः कम से कम एक सप्ताह तक दिखाई देते हैं। इन लक्षणों के अनिश्चित स्वरूप के कारण, अक्सर उन्हें एचआईवी (HIV) संक्रमण के संकेतों के रूप में मान्यता नहीं दी जाती.[३१]
इन लक्षणों के अनिश्चित स्वरूप के कारण, अक्सर उन्हें एचआईवी (HIV) संक्रमण के संकेतों के रूप में मान्यता नहीं दी जाती. भले ही मरीज अपने चिकित्सक के पास या किसी अस्पताल में जाएं, लेकिन अक्सर यह मानकर उनका गलत निदान कर दिया जाएगा कि उन्हें वे उन अधिक आम संक्रामक बीमारियों से ग्रस्त हैं, जिनमें यही लक्षण देखे जाते हैं। इसके परिणामस्वरूप, एचआईवी (HIV) संक्रमण का निदान करने के लिये इन प्राथमिक लक्षणों का प्रयोग नहीं किया जाता क्योंकि वे सभी मरीज़ों में विकसित नहीं होते और इनमें से अनेक लक्षण अन्य अधिक आम बीमारियों के कारण भी दिखाई दे सकते हैं। हालांकि, इस सिंड्रोम की पहचान महत्वपूर्ण हो सकती है क्योंकि इसी अवधि के दौरान मरीज बहुत अधिक संक्रमित होता है।[३२]
विलंबता चरण
एक मज़बूत प्रतिरोध प्रतिरक्षा रक्त के प्रवाह में जीवाण्विक कणों की संख्या को कम करती है, जिससे संक्रमण के चिकित्सीय विलंबिता चरण की शुरुआत चिह्नित की जाती है। चिकित्सीय विलंबता में दो सप्ताहों और 20 वर्षों तक का अंतर हो सकता है। संक्रमण के इस प्रारंभिक चरण के दौरान, एचआईवी (HIV) लसीका से जुड़े अंगों (lymphoid organs) के अंतर्गत सक्रिय होता है, जहां जीवाणुओं की बड़ी मात्राएं रोमकूपों की द्रुमाश्म कोशिकाओं (dendritic cells) (एफडीसी) (FDC) के नेटवर्क में फंस जाते हैं।[३३]
आस-पास के जिन ऊतकों में सीडी4+ टी (CD4+ T) कोशिकाओं की पर्याप्त मात्रा उपस्थित हो, वे भी संक्रमित हो सकते हैं और जीवाण्विक कण असंक्रमित कोशिकाओं में तथा मुक्त जीवाणुओं के रूप में, दोनों ही प्रकार से एकत्रित हो सकते हैं। इस चरण में जो व्यक्ति हैं, वे अभी भी संक्रामक हैं। इस समय के दौरान, सीडी4+ सीडी45आरओ+ टी कोशिकाएं (CD4+ CD45RO+ T cells) अधिकांश जीवाण्विक भार वहन करती हैं।[३४]
एड्स
- इस विषय पर अधिक जानकारी के लिये एड्स (AIDS) का निदान, एड्स (AIDS) के लक्षण और एचआईवी (HIV) संक्रमण एवं बीमारियों के लिये डब्ल्यूएचओ (WHO) की बीमारी चरण प्रणाली देखें
जब सीडी4+ टी (CD4+ T) कोशिकाओं की संख्या 200 कोशिकाएं प्रति µL के आवश्यक स्तर से नीचे गिर जाती है, तो कोशिकाओं की मध्यस्थता से प्राप्त प्रतिरोधक क्षमता समाप्त हो जाती है और अनेक प्रकार के अवसरवादी रोगाणुओं से होने वाले संक्रमण दिखाई देने लगते हैं। प्रारंभिक संक्रमणों में अक्सर भार में मध्यम और अस्पष्ट कमी, श्वसन तंत्र के प्रतिवर्ती संक्रमण (जैसे साइनसाइटिस (sinusitis), ब्रॉन्काइटिस (bronchitis), ओटाइटिस मीडिया (otitis media), फैरीन्जाइटिस (pharyngitis)), प्रोस्टेटाइटिस (prostatitis), त्वचा पर फुन्सियां और मुंह के छाले शामिल होते हैं।
ऐसे आम अवसरवादी संक्रमण और ट्यूमर, जिनमें से अधिकांश को सामान्यतः दृढ़ सीडी4+ टी (CD4+ T) कोशिकाओं की मध्यस्थता से प्राप्त प्रतिरोध द्वारा नियंत्रित किया जाता है, अब मरीज को प्रभावित करने लगते हैं। विशिष्ट रूप से, प्रारंभिक प्रतिरोध मौखिक कैंडिडा प्रजातियों और माइकोबैक्टेरियम ट्युबरक्युलॉसिस (Mycobacterium tuberculosis) के कारण समाप्त हो जाता है, जिसके परिणामस्वरूप मौखिक कैंडियासिस (छाला) और ट्युबरक्युलॉसिस के प्रति संवेदनशीलता बढ़ जाती है। इसके बाद, अदृश्य हर्पस विषाणुओं के पुनर्सक्रियण के कारण हर्पस सिम्प्लेक्स की बढ़ती हुई फुन्सियों, शिंगल (Shingle), एप्सटीन-बैर विषाणु-प्रवृत्त बी-कोशिका लिंफोमा (Epstein-Barr virus-induced B-cell lymphomas) अथवा कापोसी के सार्कोमा (Kaposi's sarcoma) की बिगड़ती हुई स्थिति के साथ इनकी पुनरावृत्ति हो सकती है।
न्युमोसिस्टिस जिरोवेकी (Pneumocystis jirovecii) के कारण होने वाले न्युमोनिया आम है और अक्सर यह जानलेवा भी होता है। एड्स (AIDS) के अंतिम चरणों में, साइटोमेगैलोवायरस (cytomegalovirus) (एक अन्य हर्पस विषाणु) या माइकोबैक्टेरियम एवियम कॉम्प्लेक्स (Mycobacterium avium complex) के द्वारा होने वाले संक्रमण अधिक विशिष्ट हैं। एड्स (AIDS) के सभी रोगियों में ये सभी संक्रमण या ट्यूमर नहीं होते और कुछ ऐसे ट्यूमर और संक्रमण भी हैं, जो कम विशिष्ट हैं, लेकिन फिर भी महत्वपूर्ण हैं।
रोगात्मक-शरीरविज्ञान
संचरण
अभिग्रहण का प्रति-कृत्य अनुमानित जोखिम[३५][३६] (ध्यान दें कि वाणिज्यिक यौन संपर्कों, एचआईवी (HIV) संक्रमण के चरण, जननांग में छालों की उपस्थिति या इतिहास और राष्ट्रीय आय स्तरों जैसे अन्य कारकों के कारण जोखिम की दरें बदल सकती हैं। [३७]) |
||||
| संपर्क मार्ग | किसी संक्रमित स्रोत के साथ प्रति 10,000 संपर्कों में अनुमानित संक्रमण | |||
|---|---|---|---|---|
| रक्ताधान | 9000[३८] | |||
| प्रसव | 2500[३९] | |||
| दवाओं का इंजेक्शन लेने के लिये साझा सुई का प्रयोग | 67[४०] | |||
| त्वचीय सुई छड़ | 30[४१] | |||
| ग्रहणशील गुदा मैथुन (2009 और 2010 के अध्ययन) | 170‡ (95% विश्वास अंतराल 30-890)[३७] / 143 * (95% विश्वास अंतराल 48-285)[३६] | |||
| ग्रहणशील गुदा मैथुन (1992 के अध्ययन से प्राप्त डेटा पर आधारित)* | 50[४२][४३] | |||
| खतना न किये हुए पुरुषों के लिये प्रवेशात्मक गुदा मैथुन (2010 का अध्ययन)* | 62a (95% विश्वास अंतराल 7-168)[३६] | |||
| खतना किये हुए पुरुषों के लिये प्रवेशात्मक गुदा मैथुन (2010 का अध्ययन)* | 11a (95% विश्वास अंतराल 2-24)[३६] | |||
| प्रवेशामक गुदा मैथुन (1992 के अध्ययन से प्राप्त डेटा पर आधारित)* | 6.5[४२][४३] | |||
| निम्न आय वाले देशों में महिला-से-पुरुष‡ | 38 (95% विश्वास अंतराल 13-110)[३७] | |||
| निम्न आय वाले देशों में पुरुष-से-महिला‡ | 30 (95% विश्वास अंतराल 14-63)[३७] | |||
| ग्रहणशील शिश्न-योनि मैथुन* | 10[४२][४४] | |||
| प्रवेशात्मक शिश्न-योनि मैथुन* | 5[४२] | |||
| ग्रहणशील मुख-मैथुन*§ | 1†b[४३] | |||
| प्रवेशात्मक मुख-मैथुन*§ | 0.5†b[४३] | |||
| *यह मानते हुए कि कंडोम का प्रयोग नहीं किया गया है ‡एकत्रित संचरण संभाव्यता आकलन §स्रोत किसी पुरुष पर किये गए मुख-मैथुन को संदर्भित करता है | ||||
| aध्यान दें कि अन्य अध्ययनों को इस बात के अपर्याप्त प्रमाण मिले हैं कि नर खतना पुरुषों के साथ यौन-क्रिया करने वाले पुरुषों में एचआईवी (HIV) संक्रमण या यौन रूप से संचरित होने वाले अन्य संक्रमणों के विरुद्ध रक्षा करता है[४५][४६] | ||||
| †"सर्वश्रेष्ठ अनुमानित आकलन " | ||||
| bध्यान दें कि संभावित सह-कारक, जैसे मौखिक चोट, घाव, सूजन, यौन रूप से संचरित होने वाले संलग्न संक्रमण, मुंह में स्खलित होना और व्यवस्थित प्रतिरोध को दबाना, एचआईवी (HIV) संचरण की दर में वृद्धि कर सकते हैं।[४७] | ||||
एचआईवी (HIV) के लिये तीन मुख्य संचरण मार्गों की पहचान की गई है। एचआईवी-1 (HIV-1) की तुलना में मां-से-संतान में और यौन-क्रिया मार्ग के द्वारा एचआईवी-2 (HIV-2) का संचरण होने की दर बहुत कम है।
यौन-क्रिया संबंधी
अधिकांश एचआईवी (HIV) संक्रमण असुरक्षित यौन संबंधों के कारण प्राप्त होते हैं। एचआईवी (HIV) के बारे में फैला परितोष एचआईवी (HIV) के जोखिम में एक मुख्य भूमिका निभाता है।[४][५] जब एक साथी के संक्रमित यौन-स्राव दूसरे के लैंगिक, मौखिक या गुदा की श्लेष्म झिल्ली के संपर्क में आते हैं, तब यौन-संचरण हो सकता है। उच्च-आय वाले देशों में, महिला-से-पुरुष में होने वाले संचरण की दर 0.04% प्रति कृत्य और पुरुष-से-महिला संचरण की दर 0.08% प्रति कृत्य है। विभिन्न कारणों से, निम्न-आय वाले देशों में ये दरें 4 से 10 गुना अधिक हैं।[३७] ग्रहणशील गुदा-मैथुन की दर अत्यधिक उच्च है, 1.7% प्रति कृत्य.[३७]
लैटेक्स कंडोम का सही और नियमित प्रयोग एचआईवी (HIV) के यौन संचरण के जोखिम को लगभग 85% तक कम कर देता है।[४८] हालांकि, स्पर्मीसाइड (Spermicide) वास्तव में संचरण दर को बढ़ा सकता है।[४९][५०][५१]
दक्षिण अफ्रीका,[५२] केन्या,[५३] और युगांडा[५४] में ऐसे यादृच्छिकृत नियंत्रित परीक्षण किये जाते रहे हैं, जिनमें खतना न किये हुए पुरुषों को रोगाणुहीन स्थितियों में उनका चिकित्सीय खतना करने के लिये यादृच्छिक रूप से चुना गया और उन्हें परामर्श दिया गया, जबकि अन्य पुरुषों का खतना नहीं किया गया, इनसे महिला-से-पुरुष में यौन एचआईवी (HIV) संचरण की दर में क्रमशः 60%, 53% और 51% की गिरावट देखी गई। इसके परिणामस्वरूप, डब्ल्यूएचओ (WHO) तथा यूएनएड्स (UNAIDS) सचिवालय द्वारा स्थापित एक विशेषज्ञ समिति ने “पुरुषों में विषमलिंगकामी रूप से अभिग्रहित एचआईवी (HIV) संक्रमण के जोखिम को कम करने के एक अतिरिक्त महत्वपूर्ण हस्तक्षेप के रूप में अब पुरुष खतने को भी मान्यता दिये जाने की अनुशंसा की है।"[५५] पुरुषों के साथ यौन-क्रिया करने वाले पुरुषों में, इस बात के प्रमाण अपर्याप्त हैं कि नर खतना एचआईवी (HIV) संक्रमण या अन्य यौन रूप से संचरित होने वाले संक्रमणों के खिलाफ सुरक्षा प्रदान करता है।[४५]
जिन महिलाओं में मादा जननांग कर्तन (female genital cutting) (एफजीसी) (FGC) प्रक्रिया हुई है, उनमें एचआईवी (HIV) के अध्ययनों के मिश्रित परिणाम प्राप्त हुए हैं; विवरणों के लिये मादा जननांग कर्तन#एचआईवी (HIV) देखें.
रक्त अथवा रक्त उत्पाद
सामान्यतः यदि संक्रमित रक्त किसी भी खुले घाव के संपर्क में आ जाए, तो एचआईवी (HIV) संचरित हो सकता है। इस संचरण मार्ग के कारण अंतःशिरा में नशीली दवाएं लेने वाले प्रयोक्ताओं, हीमोफीलिया से ग्रस्त लोगों और रक्ताधान (हालांकि विकसित विश्व में अधिकांश रक्ताधानों को एचआईवी (HIV) की अनुपस्थिति सुनिश्चित करने के लिये जांचा जाता है) और रक्त उत्पादों के प्राप्त कर्ताओं में संक्रमण हो सकता है। यह उन लोगों के लिये भी चिंता का विषय है, जो ऐसे क्षेत्रों में चिकित्सीय देखभाल प्राप्त कर रहे हों, जहां इंजेक्शन उपकरण के प्रयोग में स्वच्छता के घटिया स्तर प्रचलित हैं, जैसे तृतीय विश्व के देश. स्वास्थ्य सेवा कार्यकर्ताओं, जैसे परिचारिकाएं, प्रयोगशाला सहायक और चिकित्सक भी संक्रमित होते रहे हैं, हालांकि ऐसा बहुत दुर्लभ मामलों में ही होता है। जब से रक्त के द्वारा एचआईवी (HIV) का संक्रमण ज्ञात हुआ है, तब से वैश्विक सावधानियों के द्वारा रक्त के संपर्क में आने से स्वयं का बचाव करना चिकित्सीय पेशेवरों के लिये आवश्यक बना दिया गया है। जो लोग गोदने, छेदन करवाने और खुरचने की विधियां करते या करवाते हैं, उन्हें भी संक्रमण का जोखिम हो सकता है।
संक्रमित व्यक्तियों की लार, आंसू और मूत्र में एचआईवी (HIV) की मात्रा कम पाई गई है, लेकिन इन स्रावों के द्वारा संक्रमण होने का कोई भी मामला दर्ज नहीं हुआ है और इनके द्वारा संचरण होने का संभावित जोखिम नगण्य है।[५६] मच्छरों द्वारा एचआईवी (HIV) का संचरण किया जाना संभव नहीं है।[५७]
मां-से-संतान को
एक मां से उसकी संतान में एचआईवी (HIV) का संक्रमण यूटेरो में (in utero) (गर्भावस्था के दौरान), इंट्रापार्टम (intrapartum) (बच्चे के जन्म के समय), अथवा स्तनपान के द्वारा हो सकता है। उपचार के अभाव में, माता और पुत्र के बीच जन्म तक संचरण की दर लगभग 25% है।[३९] हालांकि, जहां संयोजनात्मक एंटीरेट्रोवियल दवाओं से उपचार और सीज़ेरियन सेक्शन उपलब्ध हों, वहां इस जोखिम को कम करके एक प्रतिशत तक किया जा सकता है।[३९] जन्म के बाद मां-से-संतान में होने वाले संचरण को स्तनपान पर पूर्ण प्रतिबंध लगाकर बड़े पैमाने पर रोका जा सकता है; हालांकि इसके साथ रुग्णता महत्वपूर्ण रूप से जुड़ी हुई है। अनन्य स्तनपान और नवजात शिशुओं में विस्तारित एंटीरेट्रोवियल प्रोफिलेक्सिस का प्रावधान भी इस संचरण से बचने में प्रभावी होते हैं।[५८]
बहु-संक्रमण
कुछ अन्य जीवाणुओं के विपरीत, एचआईवी (HIV) का संक्रमण अतिरिक्त संक्रमणों के खिलाफ प्रतिरोध प्रदान नहीं करता, विशिष्टतः जेनेटिक रूप से अधिक दूरस्थ जीवाणुओं की स्थिति में. अंतः- तथा आंतर-क्लेड (inter- and intra-clade) दोनों के ही अनेक संक्रमणों,[५९] और यहां तक कि बीमारी के अधिक तीव्र विकास से जुड़े संक्रमणों की भी जानकारी मिली है।[६०] बहु-संक्रमणों को दूसरे निष्पीड़न के अभिग्रहण के समय के आधार पर दो श्रेणियों में विभाजित किया गया है। सहसंक्रमण (Coinfection) का प्रयोग दो ऐसे निष्पीड़नों को संदर्भित करने के लिये किया जाता है, जो एक ही समय अभिग्रहित प्रतीत होते हैं (या जो इतने पास हों कि उन्हें अलग-अलग पहचाना न जा सकता हो). पुनर्संक्रमण (Reinfection) (या अतिसंक्रमण (superinfection)) दूसरे निष्पीड़न के साथ होने वाले वह संक्रमण है, जो पहले निष्पीड़न के इतने समय बाद होता है कि उसे मापा जा सके। पूरे विश्व में तीव्र तथा दीर्घकालीन संक्रमण दोनों में एचआईवी (HIV) के दोहरे संक्रमणों के दोनों रूपों की जानकारी मिली है।[६१][६२][६३][६४]
संरचना व जीनोम
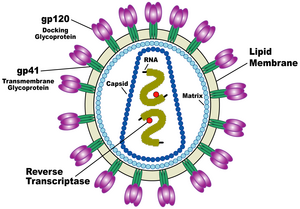
एचआईवी (HIV) की संरचना अन्य रेट्रोवायरसों से भिन्न होती है। मोटे तौर पर यह वृत्ताकार होता है[६५] और इसका व्यास लगभग 120 नैनोमीटर (nm) होता है, जो कि एक लाल रक्त कोशिका से लगभग 60 गुना छोटा होता है, लेकिन फिर भी किसी जीवाणु के संदर्भ में यह काफी बड़ा आकार है।[६६] यह धनात्मक एकल-रेशे वाले आरएनए (Single-Stranded RNA) की दो प्रतियों से मिलकर बना होता है, जो कि जीवाण्विक प्रोटीन पी24 (p24) की 2,000 प्रतियों से मिलकर बने एक शंक्वाकार कैप्सिड से घिरे जीवाणु के नौ जीनों को कूटबद्ध करता है।[६७] एकल-रेशे वाला आरएनए (RNA) न्युक्लियोकैप्सिड प्रोटीन पी7 (p7) और रिवर्स ट्रान्स्क्रिप्टेस (reverse transcriptase), प्रोटीसेस (proteases), राइबोन्युक्लीएस (ribonuclease) और इन्टीग्रेस (integrase) जैसे वायरिऑन (virion) के विकास के लिये आवश्यक किण्वकों के साथ दृढ़तापूर्वक बंधा होता है। जीवाण्विक प्रोटीन पी17 (p17) से मिलकर बना एक मैट्रिक्स कैप्सिड के चारों ओर एक घेरा बनाकर वायरिऑन कण की अखंडता को सुनिश्चित करता है।[६७]
पुनः यह एक जीवाण्विक आवरण से ढ़ंका होता है, जो कि वसायुक्त अणुओं, जिन्हें फॉस्फोलिपिड कहा जाता है और जिसे एक मानव कोशिका के मेम्ब्रेन से उस समय लिया जाता है, जब एक नवनिर्मित जीवाणु कण कोशिका से निकलता है, के दो स्तरों से मिलकर बना होता है। जीवाण्विक आवरण में मेजबान कोशिका के प्रोटीन और जटिल एचआईवी (HIV) प्रोटीन की लगभग 70 प्रतियां होती हैं, जो जीवाणु कण की सतह से होकर बाहर निकलती हैं।[६७] यह प्रोटीन, जिसे एन्व (Env) कहते हैं, ग्लाइकोप्रोटीन (जीपी) (gp) 120 नामक तीन कणों तथा तीन जीपी41 (gp41) कणों से मिलकर बने एक तने, जो संरचना को जीवाण्विक आवरण में स्थिर रखती है, से मिलकर बना होता है।[६८] यह ग्लाइकोप्रोटीन कॉम्प्लेक्स जीवाणु को लक्ष्यित कोशिकाओं से जुड़ने और मिल जाने की क्षमता प्रदान करता है, ताकि संक्रामक चक्र को प्रारंभ किया जा सके। [६८] इन दोनों सतह प्रोटीनों, विशेषतः जीपी120 (gp120) को एचआईवी (HIV) के खिलाफ भावी उपचार या टीकों का लक्ष्य माना जाता रहा है।[६९]
आरएनए (RNA) जीनोम कम से कम सात संरचनात्मक चिह्नों (एलटीआर (LTR), टीएआर (TAR), आरआरई (RRE), पीई (PE), एसएलआईपी (SLIP), सीआरएस (CRS) और आईएनएस (INS)) और नौ जीन (जीएजी (gag), पीओएल (pol), और ईएनवी (env), टीएटी (tat), आरईवी (rev), एनईएफ (nef), वीआईएफ (vif), वीपीआर (vpr), वीपीयू (vpu), और कभी-कभी दसवां टीईवी (tev), जो कि टीएटी (tat), ईएनवी (env) और आरईवी (rev) का गलन होता है) से मिलकर बना होता है, जो 19 प्रोटीनों को कूटबद्ध करते हैं। इनमें से तीन जीन, जीएजी (gag), पीओएल (pol), और ईएनवी (env), में नए जीवाणु कणों के लिये संरचनात्मक प्रोटीन बनाने के लिये आवश्यक जानकारी होती है।[६७] उदाहरण के लिये, ईएनवी (env) द्वारा जीपी160 (gp160) नामक एक प्रोटीन को कूटबद्ध किया जाता है, जिसका विघटन करके एक जीवाण्विक किण्वक जीपी120 (gp120) व जीपी41 (gp41) की रचना करता है। शेष छः जीन, टीएटी (tat), आरईवी (rev), एनईएफ (nef), वीआईएफ (vif), वीपीआर (vpr), और वीपीयू (vpu) (या एचआईवी-2 (HIV-2) की स्थिति में वीपीएक्स (vpx)), कोशिकाओं को संक्रमित करने, जीवाणु की नई प्रतिलिपियां बनाने (दोहराने) अथवा बीमारी उत्पन्न करने की एचआईवी (HIV) की क्षमता को नियंत्रित करने वाले प्रोटीन के लिये नियामक जीन हैं।[६७]
दो टीएटी (Tat) प्रोटीन (पी16 (p16) और पी14 (p14)) टीएआर (TAR) आरएनए (RNA) बंध के द्वारा कार्य करने वाले एएलटीआर (LTR) प्रचारक के लिये ट्रांस्क्रिप्शनल ट्रांसैक्टिवेटर हैं। टीएआर (TAR) को उन माइक्रोआरएनए (microRNAs) में भी प्रसंस्करित किया जा सकता है, जो ईआरसीसीआई1 (ERCC1) और आईईआर3 (IER3) एपोप्टॉसिस जीनों का नियमन करते है।[७०][७१] आरईवी (Rev) प्रोटीन (पी19) (p19) आरआरई (RRE) आरएनए (RNA) तत्व के साथ बांधकर आरएनए (RNA) को इसके केंद्र तथा कोशिकाद्रव्य से ले जाने में शामिल होता है। वीआईएफ (Vif) प्रोटीन (पी23) (p23) एपीओबीईसी3जी (APOBEC3G) (एक कोशिका प्रोटीन, जो डीएनए:आरएनए (DNA:RNA) संकरों को डीमिनेट करता है और/या पीओएल (Pol) प्रोटीन के साथ हस्तक्षेप करता है) के कार्य को रोकता है। वीपीआर (Vpr) प्रोटीन (पी14) (p14) जी2/एम (G2/M) पर कोशिका-विभाजन को रोकता है। एनईएफ (Nef) प्रोटीन (पी27) (p27) सीडी4 (CD4) (मुख्य जीवाण्विक अभिग्राहक), तथा साथ ही एमएचसी श्रेणी I (class I) व श्रेणी II (class II) अणुओं का शीघ्र-नियनम करता है।[७२][७३][७४]
एनईएफ (Nef) एसएच3 (SH3) डोमेन के साथ भी अंतःक्रिया करता है। वीपीयू (Vpu) प्रोटीन (पी16) (p16) संक्रमित कोशिकाओं से नए जीवाणु कणों की मुक्ति को प्रभावित करता है।[६७] एचआईवी (HIV) आरएनए (RNA) की प्रत्येक श्रृंखला के छोर पर एक आरएनए (RNA) क्रम होता है, जिसे लॉन्ग टर्मिलन रीपीट (long terminal repeat) (एलटीआर) (LTR) कहते हैं। एलटीआर (LTR) वाले क्षेत्र नए जीवाणुओं के उत्पादन को नियंत्रित करने वाले परिवर्तकों की तरह कार्य करते हैं और उन्हें एचआईवी (HIV) के या मेजबान कोशिका के प्रोटीनों के द्वारा सक्रिय किया जा सकता है। पीएसआई (Psi) तत्व जीवाण्विक जीनोम पैकेजिंग में शामिल होता है और इसकी पहचान जीएजी (Gag) और आरईवी (Rev) प्रोटीनों द्वारा की जाती है। स्लिप (SLIP) तत्व (टीटीटीटीटी) (TTTTTT) कार्यात्मक पीओएल (Pol) बनाने के लिये आवश्यक जीएजी (Gag)-पीओएल (Pol) वाचन फ्रेम में फ्रेम परिवर्तन में शामिल होता है।[६७]
अनुवर्तन
जीवाण्विक अनुवर्तन शब्दावली इस बात का उल्लेख करती है कि एचआईवी (HIV) किन कोशिका प्रकारों को संक्रमित करता है। एचआईवी (HIV) अनेक प्रकार की प्रतिरोधी कोशिकाओं को संक्रमित कर सकता है, जैसे सीडी4+ टी कोशिकाएं (CD4+ T cells), मैक्रोफेजेस (macrophages) और माइक्रोग्लायल (microglial) कोशिकाएं. मैक्रोफेजेस (macrophages) और सीडी4+ टी (CD4+ T) में एचआईवी-1 (HIV-1) के प्रवेश के लिये लक्ष्यित कोशिका पर वायरिऑन आवरण ग्लाइकोप्रोटीन (जीपी120) की सीडी4 (CD4) अणुओं के साथ तथा केमोकाइन सहाभिग्राहकों के साथ होने वाली अंतःक्रिया के द्वारा मध्यस्थता की जाती है।[६८]
एचआईवी-1 (HIV-1) के मैक्रोफेज (एम-अनुवर्ती) (M-tropic) खिंचाव (strains) या नॉन-सिंसिटा-इंड्यूसिंग खिंचाव (non-syncitia-inducing strains) (एनएसआई) (NSI) प्रवेश के लिये β -केमोकाइन अभिग्राहक सीसीआर5 (CCR5) का प्रयोग करते हैं और इस प्रकार मैक्रोफेजों में तथा सीडीआर4+ टी कोशिकाओं (CDR4+ T cells) में प्रतिलिपि बना पाने में सक्षम हो जाते हैं।[७५] इस सीसीआर5 (CCR5) सहाभिग्राहक का प्रयोग लगभग सभी प्रथामिक एचआईवी-1 विलगों (isolates) द्वारा जीवाण्विक जेनेटिक उप-प्रकार से निरपेक्ष रहते हुए किया जाता है। वस्तुतः मैक्रोफेज एचआईवी (HIV) संक्रमण के अनेक पहलुओं में एक मुख्य भूमिका निभाते हैं। वे एचआईवी (HIV) द्वारा संक्रमित की जाने वाली पहली कोशिकाएं प्रतीत होते हैं और संभवतः वे मरीज में सीडी4+ कोशिकाओं (CDR4+ T cells) की कमी हो जाने पर एचआईवी (HIV) के उत्पादन का स्रोत भी हैं। मैक्रोफेज और माइक्रोग्लायल कोशिकाएं एचआईवी (HIV) द्वारा केंद्रीय स्नायु तंत्र में संक्रमित की जाने वाली कोशिकाएं हैं। एचआईवी (HIV) संक्रमित मरीजों की गलतुण्डिकाओं (tonsils) तथा ग्रंथ्याभों (adenoids) में, मैक्रोफेज बहु-केंद्रीकृत विशाल कोशिकाओं में संगलित हो जाता है, जो जीवाणु की बड़ी मात्राएं उत्पन्न करती हैं।
टी-अनुवर्ती विलग (T-tropic isolates), या सिंसिटा-इंड्यूसिंग (syncitia-inducing) (एसआई) (SI) खिंचाव (strains) प्राथमिक सीडी4+ टी (CD4+ T) कोशिकाओं तथा साथ ही मैक्रोफेजों में प्रतिलिपि बनाते हैं और प्रवेश के लिये α -केमोकाइन अभिग्राहक, सीएक्ससीआर4 (CXCR4), का प्रयोग करते हैं।[७५][७६][७७] एचआईवी-1 (HIV-1) के दोहरे-अनुवर्ती खिंचावों को एचआईवी-1 (HIV-1) के पारगमन खिंचाव माना जाता है और इस प्रकार वे जीवाण्विक प्रवेश के लिये सीसीआर5 (CCR5) और सीएक्ससीआर4 (CXCR4) दोनों का प्रयोग सहाभिग्राहकों के रूप में कर पाने में सक्षम होते हैं।
α -केमोकाइन एसडीएफ-1 (SDF-1), सीएक्ससीआर4 (CXCR4) के लिये एक बंध (ligand), टी-अनुवर्ती (T-tropic) एचआईवी-1 (HIV-1) विलगों की प्रतिलिपि को रोकता है। ऐसा वह इन कोशिकाओं की सतह पर सीएक्ससीआर4 (CXCR4) की अभिव्यक्ति के शीघ्र-नियमन द्वारा करता है। केवल सीसीआर5 (CCR5) अभिग्राहक का प्रयोग करनेवाले एचआईवी (HIV) को आर5 (R5) कहा जाता है; जो केवल सीएक्ससीआर4 (CXCR4) का प्रयोग करते हैं, उन्हें एक्स4 (X4) कहा जाता है और जो दोनों का प्रयोग करते हैं, वे एक्स4आर5 (X4R5) कहलाते हैं। हालांकि, केवल सहाभिग्राहकों का प्रयोग जीवाण्विक अनुवर्तन की व्याख्या नहीं करता क्योंकि सभी आर5 (R5) जीवाणु एक उत्पादक संक्रमण के लिये मैक्रोफेक पर सीसीआर5 (CCR5) का प्रयोग कर पाने में सक्षम नहीं होते[७५] और एचआईवी (HIV) मायलॉइड डेंड्राइटिक कोशिकाओं (myeloid dendritic cells) के एक उप-प्रकार को भी संक्रमित कर सकता है,[७८] जो संभवतः एक भण्डार का निर्माण करती है, जो सीडीआर4+ टी (CD4+ T) कोशिकाओं की संख्या अत्यधिक निम्न स्तरों पर पहुंच जाने पर संक्रमण को बनाए रखता है।
कुछ लोग एचआईवी (HIV) के विशिष्ट खिंचावों के प्रति प्रतिरोधी होते हैं।[७९] उदाहरण के लिये सीसीआर5-Δ32 (CCR5-Δ32) परिवर्तन वाले लोग आर5 जीवाणु के साथ संक्रमण के प्रति प्रतिरोधी होते हैं क्योंकि यह परिवर्तन एचआईवी (HIV) को इस सहाभिग्राहक से बंधने से रोकता है, जिससे लक्ष्य कोशिकाओं को संक्रमित करने की इसकी क्षमता घटती है।
यौन-संपर्क एचआईवी (HIV) के संचरण का मुख्य माध्यम है। एक्स4 (X4) और आर5 (R5) दोनों ही एचआईवी (HIV) वीर्य के द्रव में उपस्थित होते हैं, जो पुरुष से उसके यौन-साथी में भेजा जाता है। इसके बाद वायरिऑन अनेक कोशिकामय लक्ष्यों को संक्रमित कर सकता है और पूरे जीव में बिखर जाता है। हालांकि इसके मार्ग से आर5 (R5) जीवाणु का प्रबल संचरण एक चयन प्रक्रिया के परिणामस्वरूप होता है।[८०][८१][८२] यह अभी भी शोध का विषय है कि यह चयन प्रक्रिया किस प्रकार कार्य करती है, लेकिन एक मॉडल यह है कि शुक्राणु चयनात्मक रूप से आर5 एचआईवी को वहन कर सकते हैं क्योंकि वे अपनी सतह पर सीसीआर3 (CCR3) और सीसीआर5 (CCR5) दोनों पर प्रक्रिया करते हैं, लेकिन सीएक्सआर4 (CXCR4) पर नहीं[८३] और जननांग की उपकला की कोशिकाएं एक्स4 (X4) जीवाणु को प्रमुखता से अलग करती हैं।[८४] उप-प्रकार बी एचआईवी-1 (B HIV-1) से संक्रमित मरीजों में, अक्सर बीमारी के अनुवर्ती-चरण में सहाभिग्राहक में एक परिवर्तन देखा जाता है और टी-अनुवर्ती (T-tropic) संस्करण दिखाई देते हैं, जो सीएक्ससीआर4 (CXCR4) के माध्यम से अनेक प्रकार की टी (T) कोशिकाओं को संक्रमित कर सकते हैं।[८५] अब ये संस्करण उच्च विषाक्तता के साथ अधिक आक्रामक रूप से प्रतिलिपि बनाते हैं, जिससे टी (T) कोशिकाओं की संख्या में तीव्र गिरावट आती है, प्रतिरोध तंत्र ध्वस्त हो जाता है और अवसरवादी संक्रमण उत्पन्न होते हैं, जो एड्स (AIDS) के आगमन का संकेत हैं।[८६] इस प्रकार, संक्रमण की इस यात्रा में, सीसीआर5 (CCR) की बजाय सीएक्ससीआर4 (CXCR4) के प्रयोग का जीवाण्विक अनुकूलन एड्स (AIDS) तक प्रगति में एक मुख्य चरण हो सकता है। उप-प्रकार बी (B) से संक्रमित व्यक्तियों पर किये गये अनेक अध्ययनों ने यह निर्धारित किया है कि एड्स (AIDS) के 40 से 50% मरीज़ एसआई (SI) और संभवतः एक्स4 (X4) फेनोटाइप के जीवाणुओं को आश्रय दे सकते हैं।[८७][८८]
एचआईवी-1 (HIV-1) की तुलना में एचआईवी-2 (HIV-2) बहुत कम रोगजनक होता है और इसका विश्वव्यापी वितरण सीमित है। एचआईवी-2 (HIV-2) द्वारा “सहायक जीनों” का अनुकूलन और सहाभिग्राहकों के प्रयोग का इसका अधिक प्रकीर्ण पैटर्न (सीडी4 (CD4)-स्वतंत्रता सहित) जीवाणु की सहायता इसके अनुकूलन में कर सकता है, ताकि मेजबान कोशिका में उपस्थित अंतर्जात कारकों से बचा जा सके। संचरण और उत्पादक संक्रमण को सक्षम बनाने के लिये सामान्य कोशिकामय यांत्रिकी के प्रयोग के अनुकूलन ने भी मनुष्यों में एचआईवी-2 (HIV-2) के दोहराव की स्थापना में सहायता की है। किसी भी संक्रामक दूत के लिये बचाव रणनीति अपने मेजबान मारना नहीं, बल्कि अंततः एक सहभोजी जीव बन जाना होती है। समय के साथ-साथ निम्न रोगात्मकता प्राप्त कर लेने पर, संचरण में अधिक सफल संस्करण को चुना जाएगा.[८९]
प्रतिलिपि चक्र
कोशिका में प्रवेश
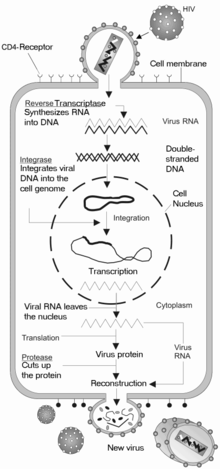
एचआईवी (HIV) अभिग्राहकों की ओर स्थित इसकी सतह पर ग्लाइकोप्रोटीनों के अधिशोषण के द्वारा मैक्रोफेजों (macrophages) और सीडी4+ टी कोशिकाओं (CD4+ T cells) में प्रवेश करता है और इसके बाद जीवाण्विक आवरण कोशिका के मेम्ब्रेन के साथ संगलित हो जाता है तथा एचआईवी (HIV) कैप्सिड को कोशिका में छोड़ दिया जाता है।[९०][९१]
कोशिका में प्रवेश की शुरुआत कोशिका की सतह पर सीडी4 (CD4) और एक केमोकाइन अभिग्राहक (सामान्यतः सीसीआर5 (CCR5) या सीएक्ससीआर4 (CXCR4), लेकिन अन्य द्वारा प्रतिक्रिया किया जाना भी ज्ञात हुआ है) दोनों के साथ ट्राइमेरिक आवरण कॉम्प्लेक्स (जीपी160 स्पाइक) (gp160 spike) की अंतःक्रिया के माध्यम से शुरु होती है।[९०][९१] जीपी120 (gp120) इंटेग्रिन α4β7 का सक्रियण करने वाले एलएफए-1 (LFA-1), जीवाण्विक सुत्रयुग्मनों की स्थापना में शामिल केंद्रीय इंटेग्रिन, से बंधता है, जो कोशिका-से-कोशिका में एचआईवी-1 (HIV-1) के दक्षतापूर्वक फैलाव को सरल बनाता है।[९२] जीपी160 (gp160) स्पाइक में सीडी4 तथा केमोकाइन अभिग्राहकों, दोनों के लिये बंधक डोमेन होते हैं।[९०][९१]
संगलन के पहले चरण में जीपी120 (gp120) के सीडी4 (CD4) बंधक डोमेनों का सीडी4 (CD4) के साथ उच्च-सादृश्य युक्त जुड़ाव शामिल होता है। एक बार जब जीपी120 (gp120) सीडी4 (CD4) प्रोटीन के साथ बंध जाता है, तो आवरण कॉम्प्लेक्स में एक संरचनात्मक परिवर्तन होता है, जिसके द्वारा जीपी120 (gp120) के केमोकाइन बंधक डोमेन उजागर हो जाते हैं और उन्हें लक्ष्य के केमोकाइन अभिग्राहकों के साथ अंतःक्रिया करने का मौका मिलता है।[९०][९१] इस कारण एक अधिक स्थिर दो-कांटों वाले जुड़ाव का निर्माण होता है, जो एन (N) -टर्मिनल संगलन पेप्टाइड जीपी41 (gp41) को कोशिका के मेम्ब्रेन का भेदन करने की अनुमति देता है।[९०][९१] इसके बाद जीपी41 (gp41) में मौजूद दोहराव क्रम, एचआर1 (HR1) और एचआर2 (HR2) अंतःक्रिया करते हैं, जिससे जीपी41 (gp41) का कोशिकाबाह्य भाग एक हेयरपिन के आकार में सिकुड़ जाता है। यह चक्राकार संरचना जीवाणु और कोशिका मेम्ब्रेन को एक दूसरे के निकट ले आती है, जिससे मेम्ब्रेनों के संगलन और परिणामित जीवाण्विक कैप्सिड के प्रवेश का मौका मिलता है।[९०][९१]
एक बार जब एचआईवी (HIV) लक्ष्य कोशिका से बंध जाता है, तो एचआईवी (HIV) आरएनए (RNA) और विभिन्न किण्वक, रिवर्स ट्रांस्क्रिप्टेस (reverse transcriptase), इंटीग्रेस (integrase), राइबोन्यूक्लियेस (ribonuclease) और प्रोटिएस (protease) सहित, कोशिका में प्रविष्ट किये जाते हैं।[९०] केंद्र की ओर माइक्रोट्युब्युल (microtubule) आधारित परिवहन के दौरान, एकल-तंतु वाले जीवाण्विक आरएनए (RNA) जीनोम को दोहरे-तंतु वाले डीएनए (DNA) में ट्रांस्क्राइब कर दिया जाता है, जिसे आगे मेजबान गुणसूत्र में एकीकृत किया जाता है।
एचआईवी (HIV) इस सीडी4 (CD4)- सीसीआर5 (CCR5) मार्ग के द्वारा द्रुमाश्म की कोशिकाओं (dendritic cells) (डीसी) (DCs) को संक्रमित कर सकता है, लेकिन मैननोस–विशिष्ट सी (C)-प्रकार के लैक्टिन अभिग्राहकों, जैसे डीसी-साइन (DC-SIGN) का प्रयोग करते हुए एक अन्य मार्ग का प्रयोग भी किया जा सकता है।[९३] (डीसी) (DCs) उन शुरुआती कोशिकाओं में से हैं, जिनसे किसी यौन संचरण के दौरान जीवाणु का सामना होता है। वर्तमान में ऐसा माना जाता है कि (डीसी) (DCs) द्वारा जब जीवाणु को श्लेष्मक में जकड़ लिया जाता है, तो वे टी (T)-कोशिकाओं में एचआईवी (HIV) का संचरण करके एक महत्वपूर्ण भूमिका निभाते हैं।[९३] ऐसा विश्वास है कि एफईज़ेड-1 (FEZ-1) की उपस्थिति, जो प्राकृतिक रूप से तंत्रिकाकोशिकाओं (neurons) में होती है, एचआईवी (HIV) द्वारा कोशिका के संक्रमण को रोकती है।[९४]
दोहराव और ट्रांस्क्रिप्शन
जीवाण्विक कैप्सिड द्वारा कोशिका में प्रवेश करने के कुछ ही समय बाद, रिवर्स ट्रांस्क्रिप्टेस (reverse transcriptase) नामक एक किण्वक एकल-रेशे वाले (+)आरएनए (RNA) जीनोम को संबंधित जीवाण्विक प्रोटीनों से मुक्त करता है और एक पूरक डीएनए (सीडीएनए) (cDNA) अणु में इसकी प्रतिलिपि बनाता है।[९५] रिवर्स ट्रांस्क्रिप्शन की प्रक्रिया में त्रुटि उत्पन्न होने की बहुत अधिक संभावना होती है और परिणामस्वरूप प्राप्त होने वाला परिवर्तन दवाओं के विरुद्ध प्रतिरोध उत्पन्न कर सकता है या जीवाणु को शरीर के प्रतिरक्षा तंत्र से बच निकलने का मौका दे सकता है। रिवर्स ट्रांस्क्रिप्टेस में राइबोन्युक्लियस गतिविधि, जो सीडीएनए (cDNA) के संश्लेषण के दौरान जीवाण्विक डीएनए (DNA) का स्तर घटा देती है, तथा साथ ही डीएनए (DNA) पर निर्भर डीएनए (DNA) बहुलक गतिविधि, जो एंटीसेन्स सीडीएनए (antisense cDNA) से एक सेन्स डीएनए (sense DNA) का निर्माण करती है, भी होती है।[९६] सीडीएनए (cDNA) और इसका पूरक एक साथ मिलकर एक दोहरे-रेशे वाले जीवाण्विक डीएनए (DNA) का निर्माण करते हैं, जिसे इसके बाद कोशिका के केंद्र में भेजा जाता है। मेजबान कोशिका के जीनोम में जीवाण्विक डीएनए (DNA) का एकीकरण एक अन्य जीवाण्विक किण्वक द्वारा होता है, जिसे इंटीग्रेस (integrase) कहते हैं।[९५]
अब यह एकीकृत जीवाण्विक डीएनए (DNA) एचआईवी (HIV) संक्रमण के दीर्घकालिक चरण में निष्क्रिय पड़ा रह सकता है।[९५] सक्रिय रूप से जीवाणु को उत्पन्न करने के लिये विशिष्ट कोशिकीय ट्रांस्क्रिप्शन कारकों का उपस्थित होना आवश्यक होता है, जिनमें से सर्वाधिक महत्वपूर्ण एनएफ़केबी (NF-κ B) (एनएफ काप्पा बी) (NF kappa B) है, जिसका उच्च-नियमन टी (T)-कोशिका के सक्रिय होने पर किया जाता है।[९७] इसका अर्थ यह है कि वर्तमान में जो कोशिकाएं संक्रमण का मुकाबला कर रही हैं, उन्हें एचआईवी (HIV) द्वारा नष्ट किये जाने की सर्वाधिक संभावना है।
जीवाण्विक दोहराव के दौरान, एकीकृत डीएनए (DNA) प्रोवायरस (provirus) एमआरएनए (mRNA) में ट्रांस्क्राइब होता है, जिसे इसके बाद छोटे-छोटे टुकड़ों में जोड़ा जाता है। ये छोटे टुकड़े केंद्र से कोशिकाद्रव्य में भेजे जाते हैं, जहां उन्हें नियामक प्रोटीन टीएटी (Tat) (जो नए जीवाणुओं के उत्पादन को प्रोत्साहित करता है) और आरईवी (Rev) में अनुवादित किया जाता है। जब यह नवनिर्मित आरईवी (Rev) प्रोटीन केंद्र में एकत्रित हो जाता है, तो यह जीवाण्विक एमआरएनए (mRNAs) से जुड़ता है और टुकड़ों में न जोड़े गए (unspliced) आरएनए (RNAs) को केंद्र से चले जाने की अनुमति देता है, जहां वे अन्यथा टुकड़ों में जोड़े जाने तक बने रहते हैं।[९८] इस चरण में, पूर्ण-लंबाई वाले एमआरएनए (mRNA) से संरचनात्मक प्रोटीन जीएजी (Gag) और ईएनवी (Env) उत्पन्न किये जाते हैं। पूर्ण-लंबाई वाला आरएनए (RNA) वस्तुतः जीवाणु जीनोम होता है; यह जीएजी (Gag) प्रोटीन से बंधता है और इसे नए जीवाणु कणों में रखा जाता है।
ऐसा प्रतीत होता है कि एचआईवी-1 (HIV-1) और एचआईवी-2 (HIV-2) अपने आरएनए (RNA) को अलग-अलग ढंग से भरते हैं; एचआईवी-1 (HIV-1) किसी भी उपयुक्त आरएनए (RNA) से बंध जाएगा, जबकि एचआईवी-2 (HIV-2) मुख्यतः उस एमआरएनए (mRNA) से बंधेगा, जिसका प्रयोग स्वतः जीएजी (Gag) प्रोटीन के निर्माण के लिये किया गया था। इसका अर्थ यह भी हो सकता है कि एचआईवी-1 (HIV-1) परिवर्तित हो पाने में बेहतर ढंग से सक्षम होता है (एचआईवी-1 (HIV-1) संक्रमण एचआईवी-2 (HIV-2) की तुलना में तेज़ी से एड्स (AIDS) की ओर बढ़ता है और यह अधिकांश वैश्विक संक्रमणों के लिये जिम्मेदार होता है).
संयोजन व मुक्ति
जीवाण्विक चक्र का अंतिम चरण, नए एचआईवी-1 (HIV-1) वायरनों (virons) का संयोजन, मेजबान कोशिका की प्लाज़्मा झिल्ली पर प्रारंभ होता है। ईएनवी (Env) बहु-प्रोटीन (जीपी160) (gp160) एंडोप्लास्मिक रेटिक्युलम (endoplasmic reticulum) से होकर गुज़रता है और इसे गॉल्गी कॉम्प्लेक्स में भेजा जाता है, जहां इसे प्रोटीएस द्वारा चीरकर दो एचआईवी (HIV) आवरण ग्लाइकोप्रोटीनों जीपी41 (gp41) और जीपी120 (gp120) में इसका प्रसंस्करण किया जाता है। इन्हें मेजबान कोशिका की प्लाज़्मा झिल्ली में भेजा जाता है, जहां जीपी41 (gp41) जीपी120 (gp120) को संक्रमित कोशिका की झिल्ली से जोड़ देता है। जब निर्मित हो रहा वायरिऑन मेजबान कोशिका उगना प्रारंभ करता है, तो जीएजी (पी55) (p55) और जीएजी-पीओल (Gag-Pol) (पी160) (p160) बहु-प्रोटीन भी एचआईवी (HIV) जीनोमिक आरएनए (RNA) के साथ प्लाज़्मा झिल्ली की आंतरिक सतह से जुड़े होते हैं। परिवर्तन या तो निर्मित हो रही कली में होता है, या मेजबान कोशिका से उगने पर अपरिपक्व वायरिऑन में. परिपक्वता के दौरान एचआईवी (HIV) प्रोटीस बहुप्रोटीनों को एकल कार्यात्मक एचआईवी (HIV) प्रोटीनों और किण्वकों में विखण्डित करते हैं। इसके बाद विभिन्न संरचनात्मक घटक संयोजित होकर एक वयस्क एचआईवी (HIV) वायरिऑन की रचना करते हैं।[९९] इस विखंडन चरण प्रोटीस निषेधकों द्वारा रोका जा सकता है। इसके बाद परिपक्व जीवाणु अन्य कोशिकाओं को संक्रमित कर पाने में सक्षम होता है।
आनुवंशिक परिवर्तिता
स्क्रिप्ट त्रुटि: "labelled list hatnote" ऐसा कोई मॉड्यूल नहीं है।
एचआईवी (HIV) अनेक जीवाणुओं से इस रूप में भिन्न है कि इसमें अति-उच्च आनुवांशिक परिवर्तिता होती है। यह विविधता इसके तीव्र दोहराव चक्र, जिसमें यह प्रतिदिन 109 से 1010 वायरिऑन उत्पन्न करता है, के साथ दोहराव के प्रत्येक चक्र में लगभग 3 x 10−5 प्रति न्युक्लिओटाइड आधार की उच्च परिवर्तन दर और रिवर्स ट्रांस्क्रिप्टेस के पुनर्संयोजनात्मक गुणों के परिणामस्वरूप प्राप्त होती है।[१००][१०१]
इस जटिल परिदृश्य के परिणामस्वरूप एक अकेले संक्रमित मरीज में एक ही दिन में एचआईवी (HIV) के अनेक संस्करण निर्मित हो जाते हैं।[१००] यह विविधता तब और अधिक बढ़ जाती है, जब किसी कोशिका को एक ही समय पर एचआईवी (HIV) के दो या दो से अधिक भिन्न खिंचावों द्वारा एक साथ संक्रमित किया जाता है। जब समकालिक संक्रमण होता है, तो इसके फलस्वरूप उत्पन्न होने वाले वायरिऑन का जीनोम में दो भिन्न खिंचावों से प्राप्त आरएनए (RNA) से मिलकर बना हो सकता है। अब यह संकर वायरिऑन एक नई कोशिका को संक्रमित करता है, जहां यह दोहराव से गुजरता है। जब ऐसा होता है, तो रिवर्स ट्रांस्क्रिप्टेस, दो भिन्न आरएनए (RNA) सांचों के बीच में कूदते हुए, एक नव-संश्लेषित रेट्रोवायरल डीएनए (DNA) अनुक्रम उत्पन्न करेगा, जो दो अभिभावक जीनोमों के बीच का एक पुनर्संयोजन होता है।[१००] यह पुनर्संयोजन तब सबसे स्वाभाविक होता है, जब यह उप-प्रकारों के बीच हो रहा हो। [१००]
अनेक खिंचावों में निकट-संबंध रखने वाला सीमियन इम्युनोडेफिशियन्सी वायरस (simian immunodeficiency virus) (एसआईवी) (SIV) उत्पन्न हुआ है, जिसे प्राकृतिक मेजबान प्रजातियों के आधार पर वर्गीकृत किया जाता है। ऐसा माना जाता है कि अफ्रीकी हरे बंदर ((एसआईवीएजीएम) (SIVagm)) और सूटी मैंगेबी के ((एसआईवीएसएमएम) (SIVsmm)) के (एसआईवी) (SIV) खिंचावों के विकास का उनके मेजबानों के साथ एक लंबा विकासपरक इतिहास रहा है। इन मेजबानों से इस जीवाणु की उपस्थिति को अनुकूलोत कर लिया है,[१०२] जो कि मेजबान के रक्त में उच्च स्तरों पर उपस्थित होता है, लेकिन केवल हल्की प्रतिरोध प्रतिक्रिया उत्पन्न करता है,[१०३] बंदरों जैसे एड्स (AIDS) के विकास का कारण नहीं बनता,[१०४] और मनुष्यों में एचआईवी (HIV) संक्रमण के विशिष्ट पुनर्संयोजन और गहन परिवर्तन से नहीं गुजरता.[१०५]
इसके विपरीत, जब ये खिंचाव उन प्रजातियों को संक्रमित करते हैं, जो एसआईवी (SIV) के प्रति अनुकूलित नहीं हैं (ह्रीसस (rhesus) या साइनोमोलोगस मकैक (cynomologus macaques) जैसे “विषम” मेजबान), तो इन पशुओं में एड्स (AIDS) विकसित हो जाता है और यह जीवाणु आनुवांशिक विविधता उत्पन्न करता है, जो कि मानव एचआईवी (HIV) संक्रमण के समान होती है।[१०६] चिंपांज़ी एसआईवी (Chimpanzee SIV) (एसआईवीसीपीज़ेड) (SIVcpz), एचआईवी-1 (HIV-1) का निकटतम आनुवांशिक संबंधी, अपने प्राकृतिक मेजबान में बढ़ी हुई मृत्यु-दर और एड्स (AIDS) जैसे लक्षणों से जुड़ा होता है।[१०७] ऐसा प्रतीत होता है कि एसआईवीसीपीज़ेड (SIVcpz) और एचआईवी-1 (HIV-1) दोनों ही चिंपांज़ियों और मनुष्यों की जनसंख्या में अपेक्षाकृत हालिया समय में संचरित हुए हैं। इसलिये उनके मेजबान अभी तक इस जीवाणु के प्रति अनुकूलित नहीं हो सके हैं।[१०२] दोनों जीवाणुओं ने अधिकांश एसआईवी (SIV) में उपस्थित एनईएफ (Nef) जीन का एक कार्य भी गंवा दिया है; इस कार्य के बिना, टी (T) कोशिका अवक्षय की संभावना बढ़ जाती है, जिससे प्रतिरक्षा में कमी (immunodeficiency) उत्पन्न होती है।[१०७]
आवरण (ईएनवी) (env) क्षेत्र में अंतरों के आधार पर एचआईवी-1 (HIV-1) के तीन समूहों की पहचान की गई है: एम (M), एन (N) व ओ (O).[१०८] समूह एम (M) सर्वाधिक प्रचलित है और इसे पूरे जीनोम के आधार पर आठ उप-प्रकारों (या क्लेड) में बांटा गया है, जो कि भौगोलोक रूप से भिन्न होते हैं।[१०९] इनमें उप-प्रकार बी (B) (उत्तरी अमरीका और यूरोप में पाया जाता है), ए (A) और डी (D) (मुख्यतः अफ्रीका में पाए जाते हैं) और सी (C) (मुख्यतः अफ्रीका और एशिया में पाया जाता है) सर्वाधिक प्रचलित हैं; ये उप-प्रकार बहु-आनुवांशिक वृक्ष में शाखाओं का निर्माण करते हैं, जो कि एचआईवी-1 (HIV-1) के एम (M) समूह के वंश का प्रतिनिधित्व करती हैं। भिन्न उप-प्रकारों के साथ सह-संक्रमण के कारण परिवाही रिकॉम्बिनेन्ट रूप (circulating recombinant forms) (सीआरएफ) (CRFs) उत्पन्न होते हैं। वर्ष 2000, जब उप-प्रकारों के वैश्विक प्रचलन का अंतिम विश्लेषण किया गया था, में वैश्विक स्तर पर 47.2% संक्रमण उप-प्रकार सी (C), 26.7% उप-प्रकार ए/सीआरएफ02_एजी (A/CRF02_AG), 12.3% उप-प्रकार बी (B), 5.3% उप-प्रकार डी (D), 3.2% सीआरएफ_एई (CRF_AE) और शेष 5.3% अन्य उप-प्रकारों तथा सीआरएफ (CRFs) से मिलकर बने थे।[११०] अधिकांश एचआईवी-1 (HIV-1) अनुसंधान उप-प्रकार बी (B) पर केंद्रित होता है; कुछ पर्योगशालाएं अन्य उप-प्रकारों पर ध्यान केंद्रित करती हैं।[१११] वर्ष 2009 में पृथक किये गये एक जीवाणु के आधार पर एक चौथे समूह, “पी (P)” के अस्तित्व की कल्पना की गई है।[११२][११३][११४] ऐसा प्रतीत होता है कि यह खिंचाव गुरिल्ला एसआईवी (SIV) (एसआईवीजीओआर) (SIVgor) से प्राप्त किया गया है, जिसे सबसे पहले वर्ष 2006 में पश्चिमी तराई वाले गुरिल्लों से अलग किया गया था।[११२]
एचआईवी-2 (HIV-2) का आनुवांशिक क्रम केवल आंशिक रूप से ही एचआईवी-1 (HIV-1) के समान है और यह एसआईवीएसएसएम (SIVsmm) के अधिक निकट दिखाई देता है।
निदान
अनेक एचआईवी-पॉज़िटिव (HIV-positive) लोग इस बात से अनभिज्ञ होते हैं कि वे जीवाणु द्वारा संक्रमित हो चुके हैं।[११५] उदाहरण के लिये, अफ्रीका की यौन-रूप से सक्रिय शहरी जनसंख्या में से 1% से भी कम की जांच की गई है और ग्रामीण जनसंख्या में तो यह अनुपात और भी कम है।[११५] इसके अतिरिक्त, शहरी स्वास्थ्य सु्विधाओं का लाभ ले रहीं केवल 0.5% गर्भवती महिलाओं को ही परामर्श दिया गया है, उनका परीक्षण किया गया है या उन्हें उनके परीक्षणों के परिणाम प्राप्त हुए हैं।[११५] पुनः ग्रामीण स्वास्थ्य सुविधाओं में यह अनुपात और भी कम है।[११५] अतः चूंकि दाता अपने संक्रमण के प्रति अनभिज्ञ हो सकते हैं, अतः चिकित्सीय अनुसंधान में प्रयुक्त दाता के रक्त या रक्त उत्पादों की एचआईवी (HIV) जांच नियमित रूप से की जाती है।[११६]
एचआईवी-1 (HIV-1) परीक्षण में एक किण्वक-संबंधी इम्युनोसॉर्बेन्ट परीक्षण (enzyme-linked immunosorbent assay) (एलिसा) (ELISA) के साथ एक प्रारंभिक जांच के द्वारा एचआईवी-1 (HIV-1) की एंटिबॉडी की पहचान की जाती है। प्रारंभिक एलिसा (ELISA) से प्राप्त गैर-प्रतिक्रियात्मक परिणाम के नमूनों को तब तक एचआईवी-निगेटिव (HIV-Negative) माना जाता है, जब तक कि किसी संक्रमित साथी के साथ या अज्ञात एचआईवी (HIV) अवस्था वाले साथी के साथ कोई नया संपर्क न हुआ हो। प्रतिक्रियात्मक एलिसा (ELISA) वाले नमूनों का प्रतिलिपि में पुनर्परीक्षण किया जाता है।[११७] यदि किसी भी प्रतिलिपि परीक्षण का परिणाम प्रतिक्रियात्मक हो, तो नमूने को दोहरावपूर्ण रूप से प्रतिक्रियात्मक कहा जाता है और एक अधिक विशिष्ट सहायक परीक्षण (उदा. वेस्टर्न ब्लॉट (Western blot) या कम प्रचलित रूप से, एक इन्म्युनोफ्लोरासेंस परीक्षण (immunofluorescence assay) (आईएफए) (IFA)) के साथ पुष्टि परीक्षण किया जाता है। केवल उन्हीं नमूनों को एचआईवी-पॉज़िटिव (HIV-Positive) और एचआईवी (HIV) संक्रमण के सूचक माना जाता है, जो दोहरावपूर्ण रूप से एलिसा (ELISA) के द्वारा प्रतिक्रियात्मक और आईएफए (IFA) द्वारा सकारात्मक या वेस्टर्न ब्लॉट (Western blot) द्वारा प्रतिक्रियात्मक हों. जो नमूने दोहरावपूर्ण रूप से एलिसा (ELISA)-प्रतिक्रियात्मक हों, वे कभी-कभी एक अनिश्चित वेस्टर्न ब्लॉट (Western blot) परिणाम प्रदान करते हैं, जो कि किसी संक्रमित व्यक्ति में एचआईवी (HIV) के प्रति एक अपूर्ण एंटीबॉडी प्रतिक्रिया, या किसी असंक्रमित व्यक्ति में गैर-विशिष्ट प्रतिक्रियाएं हो सकती हैं।[११८]
हालांकि इन अस्पष्ट मामलों में संक्रमण की पुष्टि करने के लिये आईएफए (IFA) का प्रयोग किया जा सकता है, लेकिन इस परीक्षण का प्रयोग व्यापक तौर पर नहीं किया जाता. सामान्यतः एक महीने से अधिक समय बाद एक और नमूना लिया जाना चाहिये और अनिर्धारित वेस्टर्न ब्लॉट (Western blot) परिणामों वाले व्यक्तियों का पुनर्परीक्षण किया जाना चाहिए। हालांकि यह आम तौर पर बहुत कम उपलब्ध है, लेकिन न्युक्लिक अम्ल (nucleic acid) परीक्षण (उदा., जीवाण्विक आरएनए (RNA) या प्रो-जीवाण्विक डीएनए (DNA) विस्तारण विधि) भी कुछ विशिष्ट मामलों में निदान में सहायक हो सकती है।[११७] इसके अतिरिक्त, नमूनों की निम्न गुणवत्ता के कारण कुछ जांचे गये नमूने भी अनिर्णायक परिणाम प्रदान कर सकते हैं। ऐसी स्थितियों में, एक दूसरा नमूना एकत्रित किया जाता है और एचआईवी (HIV) संक्रमण के लिये उसका परीक्षण किया जाता है।
आधुनिक एचआईवी (HIV) अत्यधिक अचूक हैं। ऐसा अनुमान है कि सामान्य अमरीकी जनसंख्या में दो-चरणों वाले परीक्षण प्रोटोकॉल में गलत-ढंग से पॉज़िटिव परिणाम मिलने की संभावना लगभग 0.0004% से 0.0007% होती है।[११९][१२०][१२१][१२२]
दवाओं की नई श्रेणियां, जैसे प्रवेश निषेधक (entry inhibitors) उन मरीजों के लिये उपचार के विकल्प प्रदान करती हैं, जो आम उपचारों के प्रति पहले प्रतिरोध-क्षम हो चुके विषाणुओं के कारण संक्रमित हुए हों, हालांकि वे व्यापक रूप से उपलब्ध तथा सीमित-संसाधनों वाली स्थापना में विशिष्ट रूप से अभिगम्य नहीं हैं।
चूंकि बच्चों, विशिष्टतः नवजात शिशुओं, में एड्स (AIDS) का विकास वयस्कों की तुलना अधिक तीव्र और कम पूर्वानुमेय होता है, अतः वयस्कों की तुलना में बच्चों में अधिक आक्रामक उपचार की अनुशंसा की गई है।[१२३] जिन विकसित देशों में हार्ट (HAART) उपलब्ध है, वहां चिकित्सक अपने मरीजों का पूर्णता से विश्लेषण करते हैं: उनके जीवाण्विक भार का, कितनी गति से सीडी4 (CD4) घटता है और मरीज इच्छुक है या नहीं, इन बातों का मापन करते हैं। इसके बाद वे इस बात का निर्णय लेते हैं कि उपचार कब शुरु करने की अनुशंसा करनी है।सन्दर्भ त्रुटि: <ref> टैग के लिए समाप्ति </ref> टैग नहीं मिला[१२४] हालांकि, पिछले दो असफल उम्मीदवार टीकों के संयोजन से बने एक टीके के बारे में सितंबर 2009 में यह जानकारी मिली थी कि थाईलैंड में किये गये एक परीक्षण में इसके प्रयोग के कारण संक्रमणों में 30% की कमी आई थी।[१२५] ऐसा माना जाता है कि इसके अतिरिक्त उजागर होने के तुरंत बाद किये जाने वाले एंटीरेट्रोवायरल उपचार, जिसे पोस्ट-एक्सपोजर प्रोफिलेक्सिस (post-exposure prophylaxis) कहते हैं, के एक कोर्स यदि यथाशीघ्र प्रारंभ कर दिया जाए, तो यह संक्रमण के जोखिम को कम कर देता है।[१२६] जुलाई 2010 में, यह देखा गया कि टेनोफोविर (tenofovir), एक रिवर्स ट्रांस्क्रिप्टेस निषेधक (reverse transcriptase inhibitor) युक्त एक योनिक जेल (vaginal gel) ने दक्षिण अफ्रीका में किये गये एक परीक्षण में एचआईवी (HIV) संक्रमण की दरों को 39 प्रतिशत तक घटा दिया.[१२७]
हालांकि, टीके तथा/या पोस्ट-एक्सपोजर प्रोफिलेक्सिस द्वारा प्रदान की जाने वाली अपूर्ण सुरक्षा के कारण, आगामी कुछ समय तक विषाणु के संपर्क से बचाव ही संक्रमण से बचने का एकमात्र उपाय होना अपेक्षित है। एचआईवी (HIV) संक्रमण के वर्तमान उपचार उच्च रूप से सक्रिय एंटीरेट्रोवायरल उपचार (highly active antiretroviral therapy), या हार्ट (HAART) से मिलकर बना होता है।[१२८] 1996 में, जब प्रोटीएस निषेधक-आधारित हार्ट (HAART) पहली बार प्रस्तुत किया गया था, तभी से यह अनेक एचआईवी (HIV)-संक्रमित लोगों के लिये अत्यधिक लाभदायक रहा है।[१२९] वर्तमान हार्ट (HAART) विकल्प संयोजन (या “कॉकटेल”) होते हैं, जिनमें एंटीरेट्रोवायरल एजेंटों के कम से कम दो प्रकारों, या “श्रेणियों”, से ली गईं कम से कम तीन दवाएं होती हैं। विशिष्ट रूप से, ये श्रेणियां दो न्युक्लियोसाइड एनालॉग रिवर्स ट्रांस्क्रिप्टेस इन्हीबिटर्स (nucleoside analogue reverse transcriptase inhibitors) (नार्टी (NARTIs) या एनआरटी (NRTIs)) तथा एक प्रोटीस इन्हीबिटर (protease inhibitor) अथवा एक गैर-न्युक्लियोसाइड रिवर्स ट्रांस्क्रिप्टेस इन्हीबिटर (non-nucleoside reverse transcriptase inhibitor) (एनएनआरटीआई) (NNRTI) होती हैं। 1-Infected Adults and Adolescents | format= PDF | accessdate=2006-01-17}}</ref>
हार्ट (HAART) न तो मरीज का उपचार करता है और न ही एक समान रूप से सभी लक्षणों को हटाता है; यदि उपचार को रोक दिया जाए, तो एचआईवी-1 (HIV-1) के उच्च स्तर, जो अक्सर हार्ट (HAART) के प्रति प्रतिरोधी होते हैं, लौट आते हैं।[१३०][१३१] इसके अतिरिक्त हार्ट (HAART) का प्रयोग करके एचआईवी (HIV) संक्रमण को हटाने के लिये पूरे जीवन-काल से अधिक समय लगेगा। [१३२] इसके बावजूद, अनेक एचआईवी (HIV)-संक्रमित व्यक्तियों ने अपने सामान्य स्वास्थ्य और जीवन की गुणवत्ता में उल्लेखनीय सुधार का अनुभव किया है, जिसके कारण विकसित विश्व में एचआईवी (HIV) से जुड़ी रुग्णता और मृत्यु दर में बड़ी गिरावट आई है।[१२९][१३३][१३४] एक अध्ययन ने सुझाव दिया कि यदि उपचार तभी से शुरु कर दिया जाए, जब सीडी4 (CD4) की संख्या 350/µL हो, तो एक एचआईवी (HIV) संक्रमित व्यक्ति का औसत संभावित जीवन-काल संक्रमण के समय से लेकर 32 वर्षों का होता है।[१३५]
यह देखा गया है कि हार्ट (HAART) की अनुपस्थिति में, एचआईवी (HIV) संक्रमण के एड्स (AIDS) में विकसित होने का मध्यमान नौ से दस वर्षों के बीच होता है, जबकि एड्स (AIDS) का विकास हो जाने पर उत्तरजीविता का मध्यमान केवल 9.2 माह होता है।[१६] हालांकि, कभी-कभी हार्ट (HAART) इष्टतम परिणामों से बहुत कम परिणाम प्राप्त करता है, कुछ स्थितियों में यह मरीजों की संख्या के पचास प्रतिशत से भी कम में प्रभावी रहा है। ऐसा अनेक कारणों से है, जैसे औषधि के प्रति असहनशीलता/दुष्प्रभाव, पूर्व में अप्रभावी रहा एंटीरेट्रोवायरल उपचार और एचआईवी (HIV) के किसी दवा-प्रतिरोधी खिंचाव के द्वारा हुआ संक्रमण. हालांकि, एंटीरेट्रोवायरल उपचार का गैर-अवलम्बन व गैर-सातत्य ही अधिकांश व्यक्तियों में हार्ट (HAART) के लाभों की प्राप्ति में विफलता का प्रमुख कारण है।[१३६]
हार्ट (HAART) के गैर-अवलम्बन व गैर-सातत्य के कारण भिन्न-भिन्न तथा अतिव्यापी हैं। मुख्य मनोवैज्ञानिक कारण, जैसे चिकित्सा देखभाल तक अच्छा अभिगमन न होना, अपर्याप्त सामाजिक समर्थन, मनोविकारी रोग और नशीली दवाओं की लत मिलकर गैर-अवलम्बन में योगदान करते हैं। इन हार्ट (HAART) परहेजों की जटिलता, चाहे गोलियों की संख्या के कारण हो, खुराक की आवृत्ति के कारण हो, भोजन में प्रतिबंधों के कारण हो या दुष्प्रभावों सहित इरादतन गैर-अवलम्बन का निर्माण करने वाले अन्य मुद्दों के कारण हो, भी इस समस्या में योगदान करती है।[१३७][१३८][१३९] दुष्प्रभावों में लाइपोडिस्ट्रॉफी (lipodystrophy), डिस्लिपिडेमिया (dyslipidemia), इंसुलिन प्रतिरोध, हृदयवाहिनी से जुड़े जोखिमों में वृद्धि और जन्म-दोष शामिल हैं।[१४०][१४१]
एचआईवी (HIV) का उपचार शुरु करने के समय को लेकर अभी भी बहस की जाती है। इस बात पर कोई विवाद नहीं है कि मरीज की सीडी4 (CD4) संख्या 200 से नीचे गिरने से पूर्व उपचार प्रारंभ कर दिया जाना चाहिये और अधिकांश राष्ट्रीय दिशानिर्देश सीडी4 (CD4) संख्या 350 से नीचे गिरने से पूर्व उपचार शुरु कर देने को कहते हैं; लेकिन सबंधित अध्ययनों कुछ ऐसे प्रमाण मिले हैं कि उपचार को सीडी4 (CD4) संख्या 350 से नीचे गिरने से पूर्व शुरु कर देना चाहिये। [१३३][१४२] जिन देशों में सीडी4 (CD4) संख्या उपलब्ध न हो, वहां डबल्यूएचओ (WHO) चरण III या IV बीमारी[१४३] वाले मरीजों का उपचार किया जाना चाहिये।
एंटी-रेट्रोवायरल दवाएं महंगी होती हैं और विश्व के अधिकांश संक्रमित व्यक्तियों के पास एचआईवी (HIV) और एड्स (AIDS) की चिकित्सा और उपचार तक अभिगमन उपलब्ध नहीं है।[१४४] वर्तमान उपचारों में सुधार के लिये किये जा रहे अनुसंधानों में, वर्तमान दवाओं के दुष्प्रभावों को कम करना, अवलम्बन को बढ़ाने के लिये दवा के परहेजों को और सरल बनाना और दवा के प्रतिरोध का प्रबंधन करने के लिये परहेजों के सर्वश्रेष्ठ क्रम का निर्धारण करना शामिल है। दुर्भाग्य से, ऐसा माना जाता है कि केवल कोई टीका ही इस महामारी को रोक पाने में सक्षम हो सकता है। ऐसा इसलिये हैं क्योंकि टीके की लागत कम होगी और इस प्रकार यह विकासशील देशों के लिये भी वहनीय होगा और इसमें दैनिक उपचार की आवश्यकता नहीं होगी। [१४४] हालांकि, 20 वर्षों के अनुसंधान के बाद भी, एचआईवी (HIV-1) टीके के लिये एक कठिन लक्ष्य बना हुआ है।[१४४]
विकसित हो रहे उपचार
2008 की मीडिया रिपोर्टों और 2009 में न्यू इंग्लैंड जर्नल ऑफ मेडिसिन (New England Journal of Medicine) ने बर्लिन के एक चिकित्सक, गेरो हटर (Gero Hütter) के एक एचआईवी (HIV)-पॉजिटिव मरीज के उपाख्यानात्मक मामले का वर्णन किया। मरीज, जिसे एक्युट माइलोजीनस ल्युकेमिया (acute myelogenous leukemia) (एएमएल) (AML) और एचआईवी (HIV) संक्रमण दोनों था, एएमएल (AML) के लिये किये गये उसके अस्थि-मज्जा प्रतिरोपण के बाद कुछ लोगों ने उसे “कार्यात्मक रूप से उपचारित” करार दिया। अस्थि-मज्जा दाता का चुनाव एक सीसीआर5(CCR5)-Δ32 परिवर्तन (जो “एचआईवी (HIV) के लगभग सभी खिंचावों के लिये प्रतिरोध प्रदान करता है) के लिये होमोज़ाइगस (homozygous) के रूप में किया गया था।[१४५][१४६] 600 दिनों तक एंटीरेट्रोवायरल दवाओं के उपचार के बिना रहने के बाद मरीज के रक्त, अस्थि-मज्जा और आंत में एचआईवी (HIV) के स्तर पहचान की सीमा से नीचे थे, हालांकि लेखकों ने अन्य ऊतकों में विषाणु की उपस्थिति की संभावना का उल्लेख किया। अनुसंधानकर्ताओं ने चेतावनी दी कि इस उपचार के उपाख्यानात्मक स्वरूप, अस्थि-मज्जा प्रतिरोपण से जुड़े मृत्यु जोखिम और अन्य चिंताओं के कारण इसे एक संभावित इलाज मान लेना अभी जल्दबाजी होगी। [१४७][१४८]
2010 में, यह कहा गया कि बैनलेक (BanLec) नामक एक रसायन एचआईवी (HIV) के दोहराव का एक प्रभावी निषेधक है।[१४९][१५०] यूनिवर्सिटी ऑफ मिशिगन (University of Michigan) के अनुसंधानकर्ताओं ने इस बात का निर्धारण किया कि बैनलेक (BanLec) एचआईवी-1 (HIV-1) के आवरण प्रोटीन जीपी120 (gp120), जिसमें उच्च शर्करा होती है, से जुड़ता है, जिससे मानव कोशिकाओं में विषाणु का प्रवेश निषिद्ध हो जाता है।[१४९][१५०] अनुसंधानकर्ताओं का सुझाव है कि एचआईवी (HIV) का ऐसा निषेधक किसी स्थानिक उपचार, जैसे योनिक माइक्रोबिसाइड (vaginal microbicide) के रूप में उपयोगी हो सकता है और इसका उत्पादन करना वर्तमान एंटीवायरल स्थानिक उपचारों से सस्ता भी हो सकता है।[१५१] एचआईवी-1 (HIV-1) संक्रमण के उपचार के लिये बैनलेक (BanLec) एफडीए (FDA) द्वारा अनुमोदित उपचार नहीं है और एचआईवी-1 (HIV-1) संक्रमण का उपचार करने या उसे रोकने के लिये इसका प्रयोग नहीं किया जाना चाहिए।
एचआईवी के अप्रकट भण्डार
एचआईवी (HIV) के संक्रमण को नियंत्रित करने और एचआईवी (HIV) संक्रमण से जुड़ी मृत्यु-दर को घटाने में अत्यधिक सक्रिय एंटीरेट्रोवायरल उपचार (हार्ट) (HAART) की सफलता के बावजूद, वर्तमान दवा परहेज एचआईवी (HIV) के संक्रमण का पूरी तरह उन्मूलन कर पाने में असमर्थ हैं। हार्ट (HAART) का प्रयोग करने वाले कई लोग एचआईवी (HIV) अनेक वर्षों तक मानक चिकित्सीय परीक्षणों की पहचान के स्तर से नीचे बनाये रखने में सफल हुए हैं। हालांकि हार्ट (HAART) का प्रयोग बंद कर देने पर, एचआईवी (HIV) विषाणु-भार सीडी4+ टी-कोशिकाओं (CD4+ T-Cells) में एक सहवर्ती कमी के साथ तीव्रता से वापस लौटता है, जो अधिकांश मामलों में, उपचार के पुनर्ग्रहण को रोकते हैं, जिसका परिणाम एड्स (AIDS) के रूप में मिलता है।
स्वयं को सफलतापूर्वक पुनरुत्पन्न करने के लिये, एचआईवी (HIV) के लिये अपने आरएनए (RNA) जीनोम को डीएनए (DNA) में रूपांतरित करना अनिवार्य होता है, जिसे इसके बाद मेजबान कोशिका के केंद्र में आयात किया जाता है और एचआईवी (HIV) इंटीग्रेस के कार्य के माध्यम से मेजबान जीनोम में प्रविष्ट किया जाता है। चूंकि एचआईवी (HIV) का मुख्य कोशिकीय लक्ष्य, सीडी4+टी कोशिकाएं (CD4+ T-Cells), प्रतिरक्षा प्रणाली की स्मृति कोशिकाओं के रूप में कार्य करतीं हैं, अतः एकीकृत एचआईवी (HIV) इन कोशिकाओं के जीवनकाल तक निष्क्रिय बना रह सकता है। स्मृति टी कोशिकाएं (Memory T-Cells) अनेक वर्षों और संभावित रूप से दशकों तक जीवित रह सकती हैं। एचआईवी (HIV) के अप्रकट भण्डार का मापन संक्रमित मरीजों की सीडी4+ टी-कोशिकाओं (CD4+ T-Cells) को असंक्रमित दाताओं की सीडी4+ टी-कोशिकाओं (CD4+ T-Cells) के साथ उगाकर और एचआईवी (HIV) या आरएनए (RNA) का मापन करके किया जा सकता है।[१५२]
एचआईवी (HIV) संक्रमण और एड्स (AIDS) के विकास के खिलाफ सुरक्षा प्रदान कर पाने में उम्मीदवार टीके की विफलता के परिणामस्वरूप एक बार फिर एचआईवी (HIV) की अव्यक्तता के लिये जिम्मेदार जैव-क्रियाविधि पर ध्यान केंद्रित हुआ है। संभव है कि एंटी-रेट्रोवायरलों को अप्रकट भंडार पर लक्ष्यित दवाओं के साथ संयोजित करके निर्मित सीमित अवधि का एक उपचार दिन एचआईवी (HIV) संक्रमण के पूर्ण उन्मूलन को संभव बना दे। [१५३]
पूर्वानुमान
ऐसा अनुमान है कि उपचार के बिना, एचआईवी (HIV) के साथ संक्रमण के बाद उत्तरजीविता का शुद्ध मध्यमान समय एचआईवी (HIV) उप-प्रकार के आधार पर 9 से 11 वर्ष होता है,[१५४] और अध्ययन के आधार पर, सीमित संसाधनों वाले जिन स्थानों पर उपचार उपलब्ध न हो, उनमें एड्स (AIDS) के निदान के बाद उत्तरजीविता दर का मध्यमान 6 और 9 माह के बीच होता है।[१५५] जिन क्षेत्रों में यह व्यापक रूप से उपलब्ध हो, वहां एचआईवी (HIV) संक्रमण और एड्स (AIDS) के लिये एक प्रभावी उपचार के रूप में हार्ट (HAART) के विकास ने इस बीमारी की मृत्यु-दर को 80% तक कम कर दिया है और जिन एचआईवी (HIV)-संक्रमित व्यक्तियों में निदान हाल ही में हुआ हो, उनमें जीवन की संभावना को 20-50 वर्षों तक बढ़ा दिया है।[१५६][१५७]
चूंकि नये उपचारों का विकास जारी है और चूंकि एचआईवी (HIV) भी इन उपचारों के विरुद्ध प्रतिरोध विकसित करना जारी रखता है, अतः उत्तरजीविता काल संबंधी आकलनों में परिवर्तन जारी रहना संभावित है। एंटी-रेट्रोवायरल उपचार के बिना, व्यक्ति में एड्स (AIDS) का विकास होने के सामान्यतः एक वर्ष के भीतर मृत्यु हो जाती है।[१६] अधिकांश मरीजों की मृत्यु अवसरवादी संक्रमणों या प्रतिरक्षा-तंत्र की बढ़ती हुई विफलता से जुड़ी असाध्यताओं के कारण होती है।[१२] बीमारी के चिकित्सीय विकास की दर व्यक्ति-दर-व्यक्ति व्यापक रूप से भिन्न होती है और ऐसा देखा गया है कि यह अनेक कारकों, जैसे मेजबान की संवेदनशीलता और प्रतिरक्षा कार्य,[७९][१५८][१५९] स्वास्थ की देखभाल और सह-संक्रमणों, आदि से[१२][१६] तथा साथ ही इस बात से प्रभावित होती है कि विषाणु का कौन-सा विशिष्ट खिंचाव विकसित हुआ है।[१६०][१६१][१६२]
महामारी-विज्ञान
यूएनएड्स (UNAIDS) और डब्ल्यूएचओ (WHO) का अनुमान है कि 1981 में पहली बार पहचाने जाने के समय से लेकर आज तक एड्स (AIDS) ने 25 मिलियन से अधिक लोगों की जान ली है, जिसके कारण यह इतिहास में दर्ज सर्वाधिक विनाशकारी महामारियों में से एक बन गया है। एक अनुमान के मुताबिक, विश्व के अनेक क्षेत्रों में एंटी-रेट्रोवायरल उपचार और देखभाल तक अभिगम में हालिया सुधार के बावजूद, एड्स (AIDS) की महामारी ने 2005 में लगभग 2.8 मिलियन (2.4 और 3.3 मिलियन के बीच) जानें लीं, जिनमें से आधे मिलियन से अधिक (570,000) बच्चे थे।[६]
2007 में, यह माना जाता था कि 30.6 और 36.1 मिलियन के बीच लोग एचआईवी (HIV) के साथ जी रहे थे और इसने उस वर्ष लगभग 2.1 मिलियन लोगों की जान ली, जिसमें 330,000 बच्चे शामिल थे; 2.5 मिलियन नए संक्रमण मिले। [१५४]
उप-सहाराई अफ्रीका अभी तक सबसे बुरी तरह प्रभावित क्षेत्र बना हुआ है और एक अनुमान के मुताबिक वर्तमान में वहां 21.6 से 27.4 मिलियन लोग एचआईवी (HIV) के साथ जी रहे हैं। उनमें से दो मिलियन (1.5–3.0 मिलियन) 15 वर्ष से कम आयु के बच्चे हैं। एचआईवी (HIV) के साथ जी रहे लोगों की कुल संख्या में से 64% लोग और एचआईवी (HIV) के साथ जी रही महिलाओं में से तीन-चौथाई से अधिक महिलाएं उप-सहाराई अफ्रीका में हैं। 2005 में, उप-सहाराई अफ्रीका 2005 में एड्स (AIDS) के कारण अनाथ हो चुके 12.0 मिलियन (10.6–13.6 मिलियन) लोग रह रहे थे।[६]
कुल संख्या के 15% के साथ दक्षिण और दक्षिण-पूर्वी एशिया दूसरे सबसे-बुरी तरह प्रभावित क्षेत्र हैं। एड्स (AIDS) इस क्षेत्र में 500,000 बच्चों की मृत्यु का कारण बनता है। दक्षिण अफ्रीका में विश्व के एचआईवी (HIV) मरीजों की सबसे बड़ी संख्या रहती है, जिसके बाद नाइजीरिया का स्थान है।[१६३] अन्य उप-सहाराई देशों, जैसे सुडान में इसके 1.6% के निम्न प्रसार की जानकारी मिली है, हालांकि यह डेटा खराब ढंग से प्रलेखित है।[१६४] एक अनुमान के मुताबिक भारत में लगभग 2.5 मिलियन संक्रमण हैं (जनसंख्या का 0.23%), जिससे भारत एचआईवी (HIV) मरीजों की तीसरी बड़ी जनसंख्या वाला देश बन गया है। सर्वाधिक प्रसार वाले 35 अफ्रीकी देशों में, औसत जीवन प्रत्याशा 48.3 वर्ष है—बीमारी की अनुपस्थिति में जीवन प्रत्याशा से 6.5 वर्ष कम.[१६५]
विश्व बैंक का कार्य मूल्यांकन विभाग (World Bank's Operations Evaluation Department) की नवीनतम रिपोर्ट विश्व-बैंक द्वारा देश-स्तर पर दी जा रही एचआईवी (HIV)/ एड्स (AIDS) सहायता की विकास प्रभावकारिता, जिसे नीति चर्चा के रूप में परिभाषित किया गया है, का मूल्यांकन, विश्लेषण और उधार देने का कार्य एड्स (AIDS) की महामारी के प्रभाव या दायरे को कम करने के स्पष्ट उद्देश्य के साथ करती है।[१६६] यह 2004 के मध्य में इस महामारी की शुरुआत से अभी तक यह विश्व बैंक द्वारा देशों को दिये जा रहे एचआईवी (HIV)/एड्स (AIDS) समर्थन का पहला व्यापक मूल्यांकन है। चूंकि बैंक का लक्ष्य राष्ट्रीय सरकार के कार्यक्रमों के क्रियान्वयन में सहायता करना है, अतः उनका अनुभव इस बारे में महत्वपूर्ण ज्ञान प्रदान करता है कि राष्ट्रीय एड्स कार्यक्रमों (National AIDS programmes) को किस प्रकार अधिक प्रभावी बनाया जा सकता है।
एचआईवी (HIV) संक्रमण के एक प्रभावी उपचार के रूप में हार्ट (HAART) के विकास ने इस बीमारी से होने वाली मौतों की दर को उन क्षेत्रों में काफी हद तक कम कर दिया है, जहां ये दवाएं व्यापक रूप से उपलब्ध हैं।[१२९] जिन देशों में हार्ट (HAART) का प्रयोग बड़े पैमाने पर किया जाता है, उनमें एचआईवी (HIV) युक्त लोगों के जीवन की संभावित अवधि बढ़ी है, अतः इस बीमारी के लगातार हो रहे प्रसार के कारण एचआईवी (HIV) के साथ जी रहे लोगों की संख्या में भी लक्षणीय वृद्धि हुई है।
अफ्रीका में, माता-से-संतान को होने वाले संचरण (mother-to-child-transmission) (एमटीसीटी) (MTCT) के मामलों की संख्या और एड्स (AIDS) के प्रसार ने बच्चों के जीवित बचने के मामलों में दशकों से जारी स्थिर प्रगति को उलटना शुरु कर दिया है। युगांडा जैसे देश वीसीटी (VCT) (स्वैच्छिक परामर्श व परीक्षण (voluntary counselling and testing)), पीएमटीसीटी (PMTCT) (माता-से-संतान में होने वाले संचरण की रोकथाम (prevention of mother-to-child transmission)) और एएनसी (ANC) (मृत्यु-पूर्व देखभाल (ante-natal care)) सेवाओं, जिनमें एंटी-रेट्रोवायरल उपचार का वितरण शामिल है, के द्वारा एमटीसीटी (MTCT) महामारी को कुचलने का प्रयास कर रहे हैं।
इतिहास
उत्पत्तियां
- एचआईवी (HIV)/एड्स (AIDS) के शुरुआती मामलों के लिये ज्ञात मामलों का इतिहास व प्रसार देखें
ऐसा माना जाता है कि एचआईवी (HIV) की उत्पत्ति उप-सहाराई अफ्रीका के गैर-मानवीय वानरों में हुई और 19वीं सदी के अंत में या 20वीं सदी के प्रारंभ में यह मनुष्यों में स्थानांतरित हुआ।[१६७] एड्स (AIDS) के अवसरवादी संक्रमणों के लक्षणों के एक पैटर्न की पहचान करने वाला पहला शोध-पत्र 1981 में प्रकाशित हुआ।[१६८]
ऐसा माना जाता है कि एचआईवी-1 (HIV-1) और एचआईवी-2 (HIV-2) दोनों की उत्पत्ति मध्य-पश्चिमी अफ्रीका में हुई और उन्होंने गैर-मानवीय नर-वानरों से मनुष्यों में प्रजातियों के बीच छलांग लगाकर (एक प्रक्रिया जिसे ज़ूनॉसिस (zoonosis) कहा जाता है) प्रवेश किया है। ऐसा प्रतीत होता है कि एचआईवी-1 (HIV-1) की उत्पत्ति दक्षिणी कैमरून में एसआईवी (सीपीज़ेड) (SIV(cpz)), जंगली चिंपांज़ी (पैन ट्रॉग्लोडाइट्स ट्रॉग्लोडाइट्स (Pan troglodytes troglodytes)) को संक्रमित करनेवाले एक सिमियन इम्युनोडेफिशियेंसी वायरस (एसआईवी (SIV)), की उत्पत्ति के माध्यम से हुई। [१६९][१७०] गिनी-बिसाउ, गैबन और कैमरून में पाये जाने वाले पुराने विश्व के एक बंदर, सूटी मैंगेबी (सेर्कोसेबस एटिस (Cercocebus atys)), का एक विषाणु एसआईवी (एजीएम) SIV(agm) एचआईवी-2 (HIV-2) का निकटतम संबंधी है।[२७] नये विश्व (New World) के बंदर, जैसे आउल मंकी (owl monkey) एचआईवी-1 (HIV-1) के प्रति प्रतिरोधी हैं, संभवतः दो विषाण्विक प्रतिरोधी जीनों के संगलन के कारण.[१७१]
खोज
वर्ष 1980 के अंत और 1981 के प्रारंभ में पहली बार एड्स (AIDS) का चिकित्सीय रूप से अवलोकन किया गया। पांच पुरुषों के एक समूह ने न्युमोसाइटिस कैरिनी (Pneumocystis carinii) निमोनिया (पीसीपी) के लक्षण प्रदर्शित किये, जो एक दुर्लभ अवसरवादी संक्रमण है, जिसके बारे में यह ज्ञात था कि वह बहुत संवेदनशील प्रतिरक्षा तंत्रों वाले लोगों में स्वयं को प्रस्तुत करता है। इसके शीघ्र बाद पुरुषों के एक अन्य समूह में कैपोसी’स सार्कोमा (Kaposi’s sarcoma) (केपी) (KP) नामक एक दुर्लभ त्वचा कैंसर विकसित हुआ। शीघ्र ही पीसीपी (PCP) और केपी (KP) के बहुत सारे अन्य मामले उभरे, जिसने अमेरिका के सेंटर्स फॉर डिसीज़ कंट्रोल एंड प्रिवेन्शन (Centers for Disease Control and Prevention) (सीडीसी) (CDC) को सतर्क कर दिया। इस प्रकोप पर नज़र रखने के लिये एक सीडीसी (CDC) कार्य-बल का निर्माण किया गया। मरीजों में स्वयं को प्रस्तुत कर रहे असामान्य लक्षणों के एक पैटर्न की पहचान कर लेने पर, इस कार्य-बल ने इस स्थिति को एक्वायर्ड इम्युनोडेफिशियेंसी सिंड्रोम (एड्स) (AIDS) का नाम दिया। [१७२]
1983 में, रॉबर्ट गैलो (Robert Gallo) और ल्युक मॉन्टैग्नियर (Luc Montagnier) के नेतृत्व वाले दो प्रृथक अनुसंधान समूहों ने स्वतंत्र रूप से यह घोषित किया कि संभवतः एक नया रेट्रोवायरस एड्स (AIDS) के मरीजों को संक्रमित करता रहा था और उन्होंने साइंस (Science) जर्नल के एक ही संस्करण में अपनी खोज प्रकाशित की। [१७३][१७४] गैलो (Gallo) ने दावा किया कि उनके समूह द्वारा एड्स (AIDS) के एक मरीज के शरीर से एक विषाणु को अलग किया है, जिसका आकार आश्चर्यजनक रूप से अन्य ह्युमन टी-लिम्फोट्रॉपिक वायरस (human T-lymphotropic viruses) (एचटीएलवी) (HTLVs) के समान है, जिसे उनके समूह ने ही सबसे पहल अलग किया था। गैलो के समूह के उनके द्वारा अलग किये गये इस नये विषाणु को एचटीएलवी-III (HTLV-III) नाम दिया। उसी समय, मॉन्टैग्नियर के समूह ने गरदन की लिंफैडेनोपैथी (लसीका-ग्रंथि (lymph node) में सूजन) और शारीरिक कमजोरी, एड्स (AIDS) के दो पारंपरिक लक्षण, प्रदर्शित कर रहे एक मरीज के शरीर से एक विषाणु को अलग किया। गैलो के समूह की रिपोर्ट का विरोध करते हुए मॉन्टैग्नियर और उनके साथियों ने यह प्रदर्शित किया कि इस विषाणु के मूल प्रोटीन एचटीएलवी-I (HTLV-I) के मूल प्रोटीन से प्रतिरक्षा-विज्ञान की दृष्टि से भिन्न थे। मॉन्टैग्नियर के समूह ने उनके द्वारा अलग किये गये इस विषाणु को लिंफैडेनोपैथी-एसोसियेटेड वायरस (lymphadenopathy-associated virus) (एलएवी) (LAV) नाम दिया। [१७२]
यह अत्यधिक बहस का विषय रहा है कि एड्स (AIDS) का कारण बननेवाले विषाणु की खोज का अधिक श्रेय गैलो या मॉन्टैग्नियर में से किसे मिलना चाहिये। अपने साथी फ्रैंकॉइसे बैरे-साइनॉसी (Françoise Barré-Sinoussi) के साथ, मॉन्टैग्नियर (Montagnier) को उनकी “ह्युमन डेफेशियेंसी वायरस की खोज के लिये” 2008 में शरीर-क्रिया विज्ञान या चिकित्सा के क्षेत्र के नोबेल पुरस्कार का आधा भाग दिया गया।[१७५] हैराल्ड ज़ुर हॉसेन (Harald zur Hausen) ने भी अपनी इस खोज के लिये यह पुरस्कार साझा किया कि ह्युमन पैपीलोमा वायरस ग्रीवा के कैंसर का कारण है, लेकिन गैलो को छोड़ दिया गया।[१७६] गैलो ने कहा कि सह-प्राप्तकर्ता के रूप में उन्हें नामित न किया जाना “निराशाजनक” है।[१७७] मॉन्टैग्नियर ने कहा कि वे “हैरान” थे कि नोबेल समिति द्वारा गैलो को मान्यता नहीं दी गई: "यह साबित करना महत्वपूर्ण था कि एचआईवी (HIV) ही एड्स (AIDS) का कारण था और इसमें गैलो की एक महत्वपूर्ण भूमिका थी। मुझे रॉबर्ट गैलो से पूरी हमदर्दी है।"[१७६]
एड्स अस्वीकृतिवाद
कुछ लोग, कुछ ऐसे वैज्ञानिकों सहित, जो एचआईवी (HIV) के मान्यता-प्राप्त विशेषज्ञ नहीं हैं,[१७८] एचआईवी (HIV) और एड्स (AIDS) के बीच संबंध,[१७९] स्वतः एचआईवी (HIV) के ही अस्तित्व, अथवा एचआईवी (HIV) के परीक्षण और उपचार की विधियों पर प्रश्नचिह्न लगाते हैं।[१७८][१८०] विश्व के वैज्ञानिक समुदाय द्वारा इन दावों, जिन्हें एड्स अस्वीकृतिवाद (AIDS denialism) के रूप में जाना जाता है, की जांच की गई है और इन्हें निरस्त कर दिया गया है,[१८१] हालांकि उन पर एक राजनैतिक प्रभाव रहा है, विशिष्ट रूप से दक्षिण अफ्रीका में, जहां सरकार द्वारा आधिकारिक रूप से किया गया एड्स अस्वीकृतिवाद (AIDS denialism) का प्रचार उस देश की एड्स (AIDS) महामारी के प्रति अप्रभावी प्रतिक्रिया के लिये जिम्मेदार था।[१८२][१८३][१८४]
सन्दर्भ
- ↑ साँचा:cite journal
- ↑ साँचा:cite journal
- ↑ साँचा:cite journal
- ↑ अ आ साँचा:cite web
- ↑ अ आ साँचा:cite web
- ↑ अ आ इ ई साँचा:cite book
- ↑ साँचा:cite book
- ↑ साँचा:cite web
- ↑ साँचा:cite journal
- ↑ साँचा:cite pmid
- ↑ साँचा:cite pmid
- ↑ अ आ इ साँचा:cite journal सन्दर्भ त्रुटि:
<ref>अमान्य टैग है; "Lawn" नाम कई बार विभिन्न सामग्रियों में परिभाषित हो चुका है - ↑ साँचा:cite journal
- ↑ साँचा:cite journal
- ↑ साँचा:cite journal
- ↑ अ आ इ ई साँचा:cite journal
- ↑ अ आ साँचा:cite doi
- ↑ साँचा:cite journal
- ↑ अ आ इ ई Goudsmit, Jaap. Viral Sex; The Nature of AIDS. Oxford University Press. New York, New York, 1997. Pg. 51-58. Retrieved May 25, 2008.
- ↑ स्क्रिप्ट त्रुटि: "citation/CS1" ऐसा कोई मॉड्यूल नहीं है।
- ↑ साँचा:cite web
- ↑ साँचा:cite web
- ↑ साँचा:cite web
- ↑ साँचा:cite journal
- ↑ साँचा:cite journal
- ↑ साँचा:cite journal
- ↑ अ आ साँचा:cite journal सन्दर्भ त्रुटि:
<ref>अमान्य टैग है; "Reeves" नाम कई बार विभिन्न सामग्रियों में परिभाषित हो चुका है - ↑ साँचा:cite journal
- ↑ साँचा:cite journal
- ↑ साँचा:cite journal
- ↑ साँचा:cite journal
- ↑ साँचा:cite journal
- ↑ साँचा:cite journal
- ↑ साँचा:cite journal
- ↑ साँचा:cite journal
- ↑ अ आ इ ई साँचा:cite journal
- ↑ अ आ इ ई उ ऊ साँचा:cite journal
- ↑ साँचा:cite journal
- ↑ अ आ इ साँचा:cite journal
- ↑ साँचा:cite journal
- ↑ साँचा:cite journal
- ↑ अ आ इ ई साँचा:cite journal
- ↑ अ आ इ ई साँचा:cite journal
- ↑ साँचा:cite journal
- ↑ अ आ साँचा:cite journal
- ↑ मूल्यों के सुधार हालाँकि "गैर-सूचक निष्कर्षों के पैटर्न स्पष्टतः प्रकाशित लेख के साथ अनुरूप है" [१] स्क्रिप्ट त्रुटि: "webarchive" ऐसा कोई मॉड्यूल नहीं है।
- ↑ साँचा:cite web
- ↑ साँचा:cite conference
- ↑ साँचा:cite web
- ↑ रोगाणुनाशक औषधियों के लिए वैश्विक अभियान: N-9 वृक्क संबंधी उपयोग स्क्रिप्ट त्रुटि: "webarchive" ऐसा कोई मॉड्यूल नहीं है। की जांच 22-07-2009
- ↑ एचआईवी (HIV) जोखिम सूची पर नानॉक्सिनॉल-9 शुक्राणुनाशक स्क्रिप्ट त्रुटि: "webarchive" ऐसा कोई मॉड्यूल नहीं है। की जांच 22-07-2009
- ↑ साँचा:cite journal
- ↑ साँचा:cite journal
- ↑ साँचा:cite journal
- ↑ साँचा:cite web
- ↑ साँचा:cite journal
- ↑ साँचा:cite web
- ↑ कोकरेन सिस्टेमटिक रिवियु ऑन इंटरवेंशन फॉर प्रिवेंशन ऑफ़ लेट पोस्टनटल मदर टू चाइल्ड ट्रांसमिशन ऑफ़ एचआईवी (HIV) http://www.cochrane.org/reviews/en/ab006734.html स्क्रिप्ट त्रुटि: "webarchive" ऐसा कोई मॉड्यूल नहीं है।
- ↑ साँचा:cite journal
- ↑ साँचा:cite journal
- ↑ साँचा:cite journal
- ↑ साँचा:cite journal
- ↑ साँचा:cite journal
- ↑ साँचा:cite journal
- ↑ साँचा:cite journal
- ↑ साँचा:cite bookमें सिंहावलोकन के साथ तुलना: पृष्ठ 3
- ↑ अ आ इ ई उ ऊ ए साँचा:cite book
- ↑ अ आ इ साँचा:cite journal
- ↑ साँचा:cite news
- ↑ साँचा:cite journal
- ↑ साँचा:cite journal
- ↑ साँचा:cite journal
- ↑ साँचा:cite journal
- ↑ साँचा:cite journal
- ↑ अ आ इ साँचा:cite journal
- ↑ साँचा:cite journal
- ↑ साँचा:cite journal
- ↑ साँचा:cite journal
- ↑ अ आ साँचा:cite journal
- ↑ साँचा:cite journal
- ↑ साँचा:cite journal
- ↑ साँचा:cite journal
- ↑ साँचा:cite journal
- ↑ साँचा:cite journal
- ↑ साँचा:cite journal
- ↑ साँचा:cite journal
- ↑ साँचा:cite journal
- ↑ साँचा:cite journal
- ↑ साँचा:cite book
- ↑ अ आ इ ई उ ऊ ए साँचा:cite journal
- ↑ अ आ इ ई उ ऊ साँचा:cite journal
- ↑ साँचा:cite journal
- ↑ अ आ साँचा:cite journal
- ↑ साँचा:cite doi
- ↑ अ आ इ साँचा:cite journal
- ↑ डॉक्टर कैसर का सूक्ष्मजैविकी गृह पृष्ठ > चतुर्थ. वाईरसेस > एफ अनिमल वाइरस लाईफ साईकल > 3 स्क्रिप्ट त्रुटि: "webarchive" ऐसा कोई मॉड्यूल नहीं है।.द लाइफ साइकल ऑफ़ एचआईवी स्क्रिप्ट त्रुटि: "webarchive" ऐसा कोई मॉड्यूल नहीं है। बाल्टीमोर काउंटी के सामुदायिक कॉलेज. अद्यतन: जनवरी 2008
- ↑ साँचा:cite journal
- ↑ साँचा:cite journal
- ↑ साँचा:cite book
- ↑ अ आ इ ई साँचा:cite journal
- ↑ साँचा:cite journal
- ↑ अ आ PMID 19661993 (PubMed)
Citation will be completed automatically in a few minutes. Jump the queue or expand by hand - ↑ साँचा:cite journal
- ↑ कुर्थ, आर. और नोर्ली, एस. (1996) एसआईवी (SIV) के प्राकृतिक पोषद वानर एड्स क्यों नहीं विकसित करते है?, जे. एनआईएच (NIH) रेस (Res) . 8, 33-37.
- ↑ साँचा:cite journal
- ↑ साँचा:cite journal
- ↑ अ आ PMID 19626114 (PubMed)
Citation will be completed automatically in a few minutes. Jump the queue or expand by hand - ↑ साँचा:cite journal
- ↑ साँचा:cite book
- ↑ साँचा:cite journal
- ↑ साँचा:cite journal
- ↑ अ आ साँचा:cite journal
- ↑ साँचा:cite news
- ↑ साँचा:cite web
- ↑ अ आ इ ई साँचा:cite journal
- ↑ साँचा:cite web
- ↑ अ आ साँचा:cite journal
- ↑ साँचा:cite journal
- ↑ साँचा:cite journal
- ↑ साँचा:cite journal
- ↑ साँचा:cite journal
- ↑ साँचा:cite journal
- ↑ साँचा:cite web
- ↑ साँचा:cite journal
- ↑ साँचा:cite news
- ↑ साँचा:cite book
- ↑ साँचा:cite journal
- ↑ साँचा:cite web
- ↑ अ आ इ साँचा:cite journal सन्दर्भ त्रुटि:
<ref>अमान्य टैग है; "Pallelal" नाम कई बार विभिन्न सामग्रियों में परिभाषित हो चुका है सन्दर्भ त्रुटि:<ref>अमान्य टैग है; "Pallelal" नाम कई बार विभिन्न सामग्रियों में परिभाषित हो चुका है - ↑ साँचा:cite journal
- ↑ साँचा:cite journal
- ↑ साँचा:cite journal
- ↑ अ आ साँचा:cite journal सन्दर्भ त्रुटि:
<ref>अमान्य टैग है; "Wood" नाम कई बार विभिन्न सामग्रियों में परिभाषित हो चुका है - ↑ साँचा:cite journal
- ↑ अ कम्प्यूटर बेस्ड स्टडी इन 2006, फोलोइंग द 2004 यूनाइटेड स्टेट्स ट्रीटमेंट गाईडलाइंस:साँचा:cite journal
- ↑ साँचा:cite journal
- ↑ साँचा:cite journal
- ↑ साँचा:cite journal
- ↑ साँचा:cite journal
- ↑ साँचा:cite journal
- ↑ साँचा:cite journal
- ↑ साँचा:cite journal
- ↑ साँचा:cite web
- ↑ अ आ इ साँचा:cite journal
- ↑ साँचा:cite web
- ↑ साँचा:cite journal
- ↑ साँचा:cite journal
- ↑ साँचा:cite journal
- ↑ अ आ साँचा:cite journal
- ↑ अ आ "अध्ययन: केले में मौजूद रासायनिक एचआईवी से लड़ने में मदद कर सकता है" स्क्रिप्ट त्रुटि: "webarchive" ऐसा कोई मॉड्यूल नहीं है।, फोक्स नियुज़, 16 मार्च 2010
- ↑ "मीशीगन विश्वविद्यालय के शोधकर्ताओं का कहना है केले में मौजूद प्रोटिन एचआईवी के ब्लोक स्प्रेड में मदद करता है" स्क्रिप्ट त्रुटि: "webarchive" ऐसा कोई मॉड्यूल नहीं है।, AnnArbor.com, 15 मार्च 2010
- ↑ साँचा:cite journal
- ↑ साँचा:cite journal
- ↑ अ आ साँचा:cite web
- ↑ साँचा:cite paper
- ↑ साँचा:cite journal
- ↑ साँचा:cite journal
- ↑ साँचा:cite journal
- ↑ साँचा:cite journal
- ↑ साँचा:cite journal
- ↑ साँचा:cite journal
- ↑ साँचा:cite journal
- ↑ साँचा:cite news
- ↑ हाकीम, जेम्ज़ (अगस्त 2009). एचआईवी/एड्स (HIV/AIDS): जानपदिक रोग-विज्ञान, निवारक और चिकित्सा पर एक अद्यतन स्क्रिप्ट त्रुटि: "webarchive" ऐसा कोई मॉड्यूल नहीं है।. [दक्षिणी सूडान मेडिकल जर्नल] .
- ↑ साँचा:cite web
- ↑ साँचा:cite web
- ↑ साँचा:cite journal
- ↑ साँचा:cite web
- ↑ साँचा:cite journal
- ↑ साँचा:cite journal
- ↑ साँचा:cite journal
- ↑ अ आ साँचा:cite journal
- ↑ साँचा:cite journal
- ↑ साँचा:cite journal
- ↑ साँचा:cite web
- ↑ अ आ साँचा:cite journal
- ↑ साँचा:cite news
- ↑ अ आ साँचा:cite book
- ↑ साँचा:cite journal
- ↑ साँचा:cite journal
- ↑ इस बात के प्रमाण के लिये कि एचआईवी (HIV) ही एड्स (AIDS) का कारण है, (उदाहरण के लिये) देखें:
- ↑ साँचा:cite journal
- ↑ साँचा:cite journal
- ↑ साँचा:cite journal
बाहरी कड़ियाँ
| एचआइवी के बारे में, विकिपीडिया के बन्धुप्रकल्पों पर और जाने: | |
|---|---|
| शब्दकोषीय परिभाषाएं | |
| पाठ्य पुस्तकें | |
| उद्धरण | |
| मुक्त स्रोत | |
| चित्र एवं मीडिया | |
| साँचा:lower | समाचार कथाएं |
| ज्ञान साधन | |
- Pages with incomplete PMID references
- Articles with 'species' microformats
- Taxoboxes with the error color
- Taxoboxes with the incertae sedis color
- Taxoboxes with no color
- Taxobox articles possibly missing a taxonbar
- Articles with hatnote templates targeting a nonexistent page
- एचआईवी/एड्स (HIV/AIDS)
- लेंटीवायरस
- रोग और संक्रमण से संचारित यौन
- रोगक्षम अपर्याप्तता
- खोज और आविष्कार विवाद
- प्रारंभिक वर्ण
- मृत्यु के कारण
- आयुर्विज्ञान
- विषाणु
- एचआइवी
- रोग
- यौन रोग
- ऍचआइवी-सम्बंधित जानकारी