विद्युत अपघटन
रसायन विज्ञान एवं निर्माण (मैन्युफैक्चरिंग) मे विद्युत अपघटन (electrolysis) उस प्रक्रिया को कहते हैं जिसके द्वारा किसी रासायनिक यौगिक में विद्युत-धारा प्रवाहित करके उसके रासायनिक बन्धों को को तोड़ा जाता है। उदाहरण के लिये जल में विद्युत धारा प्रवाहित करने पर जल, हाइड्रोजन एवं ऑक्सीजन में विघटित हो जाता है जिसे जल का विद्युत अपघटन कहते हैं। विद्युत अपघटन के बहुत से उपयोग हैं। अयस्कों को प्रसंस्कारित करके उनमें निहित रासायनिक तत्व को शुद्ध करना एवं उसे अलग करना इसका सबसे महत्वपूर्ण औद्योगिक एवं व्यावसायिक उपयोग है। लवण सेतु की आवश्यकता नही होती
संक्षिप्त इतिहास
- 1800 - विलियम निकल्सनौर जोहान रिटर ने जल का विद्युत अपघटन करके हाइड्रोजन एवं आक्सीजन प्राप्त किया।
- 1807 - हम्फ्री डेवी ने विद्युतपघटन के उपयोग से पोटैशियम सोडियम, बेरियम, एवं मैगनीसियम की खोज की।
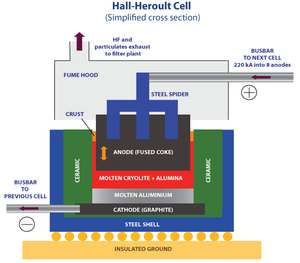
- 1886 - अलमुनियम के निष्कर्षण (extraction) के लिये हाल-हेरोल्ट (Hall-Héroult) प्रक्रिया की खोज
- 1890 - कास्टनर-केल्नर प्रक्रिया (Castner-Kellner process) द्वारा सोडियम हाइड्राक्साइड का निर्माण
परिचय
जब किसी ऑयनिक पदार्थ (जो कि विलयन के रूप में हो या पिघला हा हो) से जब विद्युत धारा प्रवाहित करते हैं तो विद्युताग्रों (एलेक्ट्रोड्स) के उपर रासायनिक अभिक्रिया होती है और इससे नये पदार्थ बनते हैं।
विद्युत अपघटन के लिये आवश्यक अवयव
- विद्युत अपघट्य (electrolyte) - किसी द्रव में स्थित चलायमान ऑयन
- दिष्ट धारा का स्रोत
- दो ठोस प्लेटें या छड़े, जिन्हें एलेक्ट्रोड कहते हैं
उपरोक्त अवयवों की भूमिका इस प्रकार है-
- चलायमान ऑयन विद्युतधारा के प्रवाह के लिये "वाहक" (कैरिअर) का काम करते हैं। यदि आयन चलायमान न हों (जैसे किसी ठोस में) तो विद्युत अपघ्टन सम्भव नहीं होगा।
- बाहर से विद्युत धारा प्रवाहित करने से आयन बनने या "डिस्चार्ज" होने के लिये आवश्यक उर्जा प्राप्त होती है।
- दो विद्युताग्र - बाहरी विद्युत परिपथ एवं आयनिक विलयन को विद्युतीय दृष्टि से जोडने का काम करते हैं।
विद्युताग्र, विद्युत के चालक होने चाहिये। धातु, ग्रेफाइट और अर्धचालक पदार्थों के एलेक्ट्रोड बहुता प्रयोग में लाये जाते हैं। एलेक्ट्रोड के पदार्थ का चुनाव इन् बातों से प्रभावित होता है-
- एलेक्ट्रोड और एलेक्ट्रोलाइट के बीच कोई क्रिया नहीं होनी चाहिये।
- एलेक्ट्रोड के निर्माण का ख्र्च कम होना चाहिये।
विद्युत अपघटन के औद्योगिक उपयोग
- Production of aluminium, lithium, sodium, potassium, magnesium
- Production of hydrogen for hydrogen cars and fuel cells; high-temperature electrolysis is also used for this
- Coulometric techniques can be used to determine the amount of matter transformed during electrolysis by measuring the amount of electricity required to perform the electrolysis
- Production of chlorine and sodium hydroxide
- Production of sodium chlorate and potassium chlorate
- Production of perfluorinated organic compounds such as trifluoroacetic acid
- Production of electrolytic copper as a cathode, from refined copper of lower purity as an anode.
- अन्य उपयोग -
- Electrometallurgy is the process of reduction of metals from metallic compounds to obtain the pure form of metal using electrolysis. For example, sodium hydroxide in its molten form is separated by electrolysis into sodium and oxygen, both of which have important chemical uses. (Water is produced at the same time.)
- Anodization is an electrolytic process that makes the surface of metals resistant to corrosion. For example, ships are saved from being corroded by oxygen in the water by this process. The process is also used to decorate surfaces.
- A battery works by the reverse process to electrolysis. Humphry Davy found that lithium acts as an electrolyte and provides electrical energy.
- Production of oxygen for spacecraft and nuclear submarines.
- Electroplating is used in layering metals to fortify them. Electroplating is used in many industries for functional or decorative purposes, as in vehicle bodies and nickel coins.
- Production of hydrogen for fuel, using a cheap source of electrical energy.
- Electrolytic Etching of metal surfaces like tools or knives with a permanent mark or logo.
- Electrolysis is also used in the cleaning and preservation of old artifacts. Because the process separates the non-metallic particles from the metallic ones, it is very useful for cleaning old coins and even larger objects.
पानी का विद्युत अपघटन
जल का विद्युत अपघटन करने के लिये दिष्ट धारा (डीसी) का कोई स्रोत आवश्यक होता है, जैसे बैटरी या डीसी जनित्र या रेक्टिफायर आदि। पानी के विद्युत अपघटन से हाइड्रोजन और आक्सीजन प्राप्त होते हैं। पानी से हाइड्रोजन की प्राप्ति इसे महत्वपूर्ण बनाती है।
- 2H2O(l) → 2H2(g) + O2(g); E0 = 1.229 V
हाइड्रोजन बहुत उपयोगी है। इसका उपयोग अन्तर्दहन इन्जनों में इंधन के रूप में किया जा सकता है अथवा इसे इंधन सेल (फुएल सेल) में उपयोग करके उससे विद्युत मोटरें चलाने के काम में लाया जा सकता है।
प्रयोगकर्ता (Experimenters)
विद्युत अपघटन के क्षेत्र में अग्रणी कार्य करने वाले कुछ व्यक्तियों के नाम -
- एन्टोनी लेवासे (Antoine Lavoisier)
- राबर्ट बुंसेन (Robert Bunsen)
- हम्फ्री डेवी (Humphry Davy) - जिसका अभय दीप (सेफ्टी लैम्प) प्रसिद्ध है।
- माइकल फैराडे (Michael Faraday)
- पॉल हेरोल्ट (Paul Heroult)
- स्वान्ते अर्हीनियस (Svante Arrhenius)
- कोल्बे (Adolph Wilhelm Hermann Kolbe)
- विलियम निकोल्सन (रसायनज्ञ) (William Nicholson)
- गे लुसाक (Joseph Louis Gay-Lussac)
- वॉन हम्बोल्ट (Alexander von Humboldt)
- वोल्टा (Alessandro Volta)
इन्हें भी देखें
- फैराडे का विद्युत अपघटन का नियम (Faraday's law of electrolysis)
- हाइड्रोजन तकनीकों की समय-रेखा (Timeline of hydrogen technologies)
- जल का विद्युत अपघटन