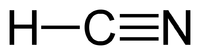हाइड्रोजन सायनाइड
हाड्रोजन सायनाइड (HCN) या हाइड्रोसायनिक या मीथेन नाइट्राइल भी कहते हैं
एक अकार्बनिक यौगिक है। इसे प्रूसिक अम्ल (Prussic acid) भी कहते हैं। यह रंगहीन वाष्पशील पदार्थ है, जो बहुत ही विषैला होता है। सन् १७८२ में के। डब्लू. शेले (K.W. Scheele) ने इसका पता लगाया था और प्रशियन नील (prussian blue) से इसे प्राप्त किया था। यह कुछ पेड़ों में शर्करावर्गीय पदार्थों के साथ ग्लाइकोसाइड के रूप में पाया जाता है। कडुवे बादाम में पाए जानेवाले ऐमिग्डालिन (amygdalin) नामक ग्लाइकोसाइड में यह होता है और ऐमिग्डालिन के जल अपघटन (hydrolysis) से इसे प्राप्त किया जा सकता है।
हाइड्रोजन सायनाइड का उत्पादन औद्योगिक स्तर पर किया जाता है। अनेकों रासायनिक यौगिकों (बहुलक एवं औषध) के निर्माण में यह अत्यन्त उपयोगी है।
तैयार करने की विधि
प्रयोगशाला में इसे प्राप्त करने की विधि यह है : १०० मिली। सांद्र सल्फ्यूरिक अम्ल का उतने ही जल में ठंढा विलयन एक गोल पेंदी के फ्लास्क में रखे १०० ग्राम पोटैशियम सायनाइड के ऊपर क्रमश: डालते हैं। इस फ्लास्क को एक य नली से जोड़ दिया जाता है, जिसमें निर्जलित कैल्सियम क्लोराइड भरा होता है। इस नली से निकलनेवाले वाष्प को एक संघनित्र से ले जाकर द्रवीभूत करके इकट्ठा कर लेते हैं। संघनित्र में जल के स्थान पर -१० डिग्री सें. ताप का, जल में नमक का, विलयन प्रवाहित करते हैं। यदि प्राप्त अम्ल को और अधिक निर्जलित करना हो, तो उसमें कुछ फॉस्फोरस पेंटॉक्साइड डालकर हिलाते हैं और द्रव का पुन: आसवन कर लेते हैं।
प्रूसिक अम्ल बनाने की व्यावसायिक विधि यह है : २३% सोडियम सायनाइड के जलीय विलयन पर सल्फ्यूरिक अम्ल की अभिक्रिया सीसे के स्तर लगे एक जनित्र (generator) के अंदर करते हैं और इस क्रिया द्वारा प्राप्त वाष्पों को संघनित कर इकट्ठा कर लेते हैं। इस क्रिया के अंतर्गत अम्ल की मात्रा को सायनाइड की मात्रा से अधिक रखा जाता है। इस प्रकार प्राप्त द्रव के आंशिक आसवन से लगभग ९८% सांद्रता का प्रूसिक अम्ल प्राप्त हो जाता है। इसी प्रकार सोडियम सायनाइड के स्थान पर कैल्सियम सायनाइड लेकर भी इसे प्राप्त किया जा सकता है।
जर्मनी में इस अम्ल की काफी मात्रा, चुकंदर से बननेवाली शर्करा के उद्योग में प्राप्त शीरे (molasses) से भी बनाते हैं।
इन विधियों के अतिरिक्त संश्लेषण द्वारा भी प्रूसिक अम्ल प्राप्त किया जाता है। इसके लिए दो प्रमुख विधियाँ हैं। पहली विधि में किसी हाइड्रोकार्बन तथा अमोनिया के मिश्रण का नियंत्रित ऑक्सीकरण किया जाता है। मिथेन, अमोनिया तथा ॲक्सीजन की अल्पमात्रा, (पूर्ण दहन के लिए आवश्यक मात्रा से कम) के मिश्रण के एक तप्त प्लैटिनम-इरीडियम की जाली के ऊपर से प्रवाहित करते हैं। निम्नलिखित क्रिया के फलस्वरूप प्रूसिक अम्ल प्राप्त हो जाता है :
- 2CH4 + 3NH3 + 3O2 --> 2HCN + 6H2O
मेथेन के स्थान पर और दूसरे हाइड्रोकार्बन भी प्रयुक्त किए जा सकते हैं पर मेथेन से अभिक्रिया ज्यादा ठीक होती है।
फार्मेमाइड के निर्जलीकरण (dehydration) द्वारा भी प्रूसिक अम्ल बनाया जा सकता है। वाष्पीकृत फार्मेमाइड को अमोनिया की अधिक मात्रा में मिश्रित करके उत्प्रेरक, एल्यूमिनियम फॉस्फेट, के ऊपर ३६० डिग्री सें. ताप पर प्रवाहित किया गया है :
- HCONH2 --> HCN + H2O
उपर्युक्त समीकरण रासायनिक क्रिया प्रदर्शित करता है। इस प्रकार बने प्रूसिक अम्ल को सोडियम हाइड्रॉक्साइड विलयन में शोषित कर लिया जाता है जिससे वह सोडियम सायनाइड के रूप में प्राप्त हो जाता है।
भौतिक तथा रासायनिक गुणधर्म
प्रूसिक अम्ल का क्वथनांक २५.७ डिग्री सें. है। ठंडा करने पर यह बर्फ के समान ठोस के रूप में जम जाता है जिसका द्रवणांक -१४.९ डिग्री सें. है। जमी अवस्था में भी यह काफी वाष्पशील होता है। इसके अणु, प्रबल ध्रुवीय आचरणवाले होते हैं और इस बात में यह जल से काफी समानता प्रदर्शित करता है। जल की ही तरह यह आयनीकारक विलायक (ionising solvent) भी है। जल तथा अन्य कार्बनिक विलायकों के साथ यह हर अनुपात में मिश्रणीय है। प्रूसिक अम्ल में विद्यमान तत्व हाइड्रोजन, कार्बन तथा नाइट्रोजन निम्नलिखित दो संभव प्रकारों से संयुक्त हो सकते हैं।
- H-C N या H-N C
जिनको सामान्य (normal) रूप तथा आइसो (iso) रूप कहते हैं। डाइजोमोथेन (diazomethane) पर प्रूसिक अम्ल की अभिक्रिया से मेथिल सायनाइड (CH3CN) तथा मेथिल आयसो सायनाइड (CH3NC) दोनों प्राप्त होते हैं। इससे स्पष्ट है कि द्रवित प्रूसिक अम्ल में ये दोनों रूप एक साथ ही विद्यमान हैं और ये चल समावयवता (dynamic isomerism) या चलावयवता (tautomerism) प्रदर्शित करते है। जलीय विलयन में १२रूसें. पर प्रूसिक अम्ल का वियोजन स्थिरांक (dissociation constant) १.३व्१०-२ है, जो कार्बनिक अम्ल के वियोजन स्थिरांक का ही होता है। अत: स्पष्ट है कि यह बहुत ही दुर्बल अम्ल है।
प्रूसिक अम्ल का बहुलकीकरण
शुद्ध अवस्था में प्रूसिक अम्ल स्थायी पदार्थ है, जिसे काँच के बर्तन में काफी दिन तक अपरिवर्तित अवस्था में रखा जा सकता है। कुछ क्षारीय पदार्थ, जैसे अमोनिया या सोडियम सायनाइड की उपस्थिति में अम्ल का बहुलकीकरण क्रमश: प्रारंभ होने लगता है और इसी क्रिया के फलस्वरूप एक काला सा पदार्थ प्राप्त होता है जिसका रासायनिक संगठन लगभग वही होता है, जो प्रूसिक अम्ल का। इस क्रिया में पर्याप्त मात्रा में ऊष्मा निकलती है। साथ ही ऊष्मा व्यवहृत करने से अभिक्रिया का वेग भी बढ़ता है। अत: अधिक मात्रा में इस पदार्थ का बहुलकीकरण होने से ताप की वृद्धि के साथ साथ विस्फोट हो जाने की भी काफी संभावना रहती है। अम्लीय या जल के साथ अम्ल पैदा कर देनेवाले पदार्थों की उपस्थिति में इस अम्ल को स्थायीकृत (stabilised) बनाया जा सकता है।
रासायनिक क्रियाएँ
इस अम्ल के ऐस्टर साधारण विधि से नहीं बनाए जा सकते। इसके लिए ऐल्किल हैलाइड या सल्फेट पर सोडियम या पोटैशियम सायनाइड की क्रिया करनी पड़ती है:
- R-X + KCN --> R-CN + KX
इसके अतिरिक्त ऐल्किल सायनाइड, अम्लों के ऐमाइडों के अनाद्रीकरण से भी बनाए जा सकते हैं, जिससे स्पष्ट है कि यह यौगिक सामान्य सायनाइड (normal cyanide) मू-का ना [R-C N] हैं तथा इनको उन अम्लों का नाइट्राइल भी कहते हैं, क्योंकि इनके जलअपघटन से वे अम्ल प्राप्त हो जाते हैं:
प्रूसिक अम्ल एल्डिहाइडों या कीटोनों से क्रिया करके योगशील पदार्थ (addition products) बनाते हैं और इन यौगिकों का हाइड्रॉक्सी अम्लों के संश्लेषण में विशेष महत्व है। प्रूसिक अम्ल एथिलीन ऑक्साइड से (उच्च ताप, दाब तथा उत्प्रेरकों की उपस्थिति में) एथिलीन सायनहाइड्रिन बनाता है, जो कुछ उत्प्रेरकों की उपस्थिति में आसुत किए जाने पर जल का एक अणु निकालकर एक यौगिक ऐक्रिलो नाइट्राइल [CH2=CH-CN] बनाता है। संश्लेषित रबर, रेशे तथा अन्य उद्योगों में इस यौगिक का विशेष महत्व है। अत: उपर्युक्त क्रिया इस यौगिक के व्यापारिक निर्माण में काम आती है।
क्लोरीन के साथ प्रूसिक अम्ल की क्रिया से सायनोजन क्लोराइड और इसी प्रकार ब्रोमीन के साथ सायनोजन ब्रोमाइड बनते हैं, जो बड़े काम के हैं। अम्लों की उपस्थिति में प्रूसिक अम्ल जल के १ या २ अणु लेकर फार्मेमाइड (HCONH2) या अमोनिया फार्मेट (HCOONH4) बनाता है। तथा इसके जल अपघटन से फ़ार्मिक अम्ल (HCOOH) बनता है। इसके हाइड्रोजनीकरण या अपचयन से मेथिल एमिन (CH3NH2) बनता है।
धात्विक सायनाइड
अधिकांश अभिक्रियाओं में सायनाइड मूलक (-CN) एकसंयोजी अधात्विक तत्व का सा व्यवहार करता है। जिस प्रकार धातुओं के हैलाइड होते हैं, उसी प्रकार धातुओं के सायनाइड भी होते हैं। क्षारीय धातुओं के सायनाइडों, जैसे सोडियम या पोटैशियम सायनाइड में यह समानता अधिक स्पष्ट है। इसके अतिरिक्त सायनोजन मूलक जटिल यौगिक (complex compound) भी बनाता है, जैसे पोटैशियम फेरोसायनाइड, [K4Fe(CN)6]। आठवें वर्ग की धातुओं में तथा संक्रमण (transitional) धातुआं में जटिल सायनाइड बनाने की क्षमता बहुत अधिक है।
सोडियम सायनाइड
व्यवसायों में प्रयुक्त होनेवाले प्रूसिक अम्ल के लवणों में सोडियम सायनाइड प्रमुख है। शुद्ध अवस्था में यह कास्टनर (Castner) विधि से धात्विक सोडियम की अमोनिया तथा कोयले पर अभिक्रिया से प्राप्त किया जाता है। इसे, प्रूसिक अम्ल को सोडियम हाइड्रॉक्साइड विलयन में अवशोषित करके भी बनाया जा सकता है, पर इस प्रकार प्राप्त सोडियम सायनाइड कम शुद्ध होता है। प्राप्त लवण, [Na CN, 2H2O], जल, ऐल्कोहाल तथा अनार्द्र अमोनिया में विलेय होता है तथा इसका गलनांक ५६३.७ डिग्री सें. है। जलीय विलयन में यह अपघटित हो जाता है, जिसके फलस्वरूप प्रूसिक अम्ल तथा सोडियम हाइड्रॉक्साइड प्राप्त होते हैं:
- NaCN + H2O --> NaOH + HCN
सोडियम सायनाइड के जलीय विलयन के गर्म करने पर जल अपघटन से सोडियम फॉर्मेट तथा अमोनिया प्राप्त होते हैं।
- NaCN + 2H2O --> HCOONa + NH3
इसी प्रकार पोटैशियम सायनाइड भी प्राप्त हो सकता है। कार्बनिक रसायन की क्रियाओं में प्रूसिक अम्ल के इन दोनों लवणों का विशेष महत्व है।
कैल्सियम सायनाइड
इस लवण का व्यावसायिक महत्व, कैल्सियम सायनाइड द्वारा इसे निर्माण के कारण बहुत बढ़ गया है। शुद्ध अवस्था में यह सफेद चूर्ण के रूप में होता है और धूमक (Fumigants) के रूप में इसका बहुत प्रयोग होता है।
कुछ अन्य धात्विक सायनाइड, जैसे क्यूप्रमसायनाइड, सिल्वरसायनाइड तथा जिकसायनाइड अनेक व्यवसायों तथा रासायनिक क्रियाओं में काम आते हैं।
संकर सायनाइड
पोटैशियम फेरोसायनाइड [K4Fe(CN)6] तथा पोटैशियम फेरोसायनाइड [K3Fe(CN)6] प्रूसिक अम्ल के संकर लवण हैं, जो रासायनिक विश्लेषण में, प्रशियन नील बनाने में, रंजक उद्योगों में तथा आयरन सायनाइड नील नामक वर्णकों (pigments) में बड़ा महत्व रखते हैं।
प्रूसिक अम्ल की विषैली प्रकृति
प्रूसिक अम्ल तथा इसके लवण, जैसे पोटैशियम सायनाइड, बहुत विषैले पदार्थ हैं तथा बहुत ही कम मात्रा में भी घातक सिद्ध होते हैं, जो कोशिकीय ऑक्सीकरण क्रिया के अवरोधन के कारण होता है। इस विष के लक्षण शिरोभ्रमण (dizziness), मतली (nausea), लड़खड़ाना (staggering), बेहोशी तथा अंत में मृत्यु है। इस विष के प्राथमिक उपचार के लिए रोगी को खुली हवा में लिटाकर गरम रखना चाहिए। यदि सांस चल रही हो, तो एक कपड़े में कुछ बूँदे एमिल नाइट्राइट लेकर नाक में लगभग ३० सेकंड के लिए रखना चाहिए या अमोनिया एरोमेटिक स्पिरिट सुँघाना चाहिए। यदि रोगी को कुछ होश हो तो उसे एक प्रति शत सोडियम थायोसल्फेट या साबुन का जल मुख द्वारा प्रति १५ मिनट में देना चाहिए, जब तक कि वमन न होने लगे। बेहोश रोगी को मुख से कुछ न देना चाहिए। यह विष इतना तीव्र होता है कि कोई विरला ही बच पाता है और मृत्यु बहुत जल्द हो जाती है।
विनाशी कीट नियंत्रण
साधारण कीटों तथा विनाशी कीटों के नियंत्रण के लिए प्रूसिक अम्ल का महत्व सबसे पहले सन् १८८६ में कैलीफॉर्निया में नारंगी जाति के पेड़ों में विनाशीकीट मारक के रूप में ज्ञात हुआ था। गोदामों, जहाजों, रेलों आदि में जहाँ सामान इकट्ठा रहता है, इसका उपयोग धूमक के रूप में किया जाता है। इस कार्य के लिए प्रूसिक अम्ल लोहे के बेलनों में संचित रहता है। इसके अतिरिक्त अन्य रूपों में भी इसका उपयोग किया जाता है। कैल्सियम सायनाइड का विनाशीकीट मारक के रूप में प्रयोग किया जाता है, जो हवा की नमी के द्वारा प्रूसिक अम्ल का वाष्प देता है। चूहे, बिज्जू आदि के मारने में भी कैल्सियम सायनाइड का प्रयेग करते हैं। चींटी, दीमक आदि के घोंसलों को कैल्सियम सायनाइड द्वारा धूमित करके नष्ट किया जा सकता है। अनाज के गोदामों में धूमीकरण में भी कैल्सियम सायनाइड का उपयोग होता है।