आरएनए हस्तक्षेप
आरएनए हस्तक्षेप (RNAi) सजीव कोशिकाओं के अंदर की एक प्रणाली है जो यह नियंत्रण करने में सहायता करती है कि कौन-कौन से जीन सक्रिय हैं और कितने सक्रिय हैं। आरएनए अणुओं के दो छोटे प्रकार - माइक्रोआरएनए (miRNA) और लघु हस्तक्षेप करने वाले आरएनए (siRNA)- आरएनए हस्तक्षेप के केन्द्र में होते हैं। RNAs जीन के प्रत्यक्ष उत्पाद्य होते हैं और ये छोटे RNAs अन्य विशिष्ट RNAs से जुड़े हुए हो सकते हैं और उनकी गतिविधियों को या तो बढ़ा सकते हैं या घटा सकते हैं, उदाहरण के लिए वे एक मैसेंजर आरएनए को प्रोटीन उत्पादन करने से रोक सकते हैं। कोशिकाओं को परजीवी जीनों - वायरस एवं ट्रांसपोसोन - से बचाने में आरएनए हस्तक्षेप की महत्वपूर्ण भूमिका होती है, लेकिन साधारणत: यह विकास के निर्देशन के साथ ही जीन अभिव्यक्ति में भी अपनी भूमिका निभाता है।
पशुओं के साथ कई यूक्रायोट में आरएनएआई (RNAi) मार्ग पाया जाता है और एंजाइम डिसर द्वारा प्रारंभ किया जाता है, जो लंबे दुहरे-धंसे हुए आरएनए (dsRNA) अणुओं को ~20 न्युक्लिओटाइड के छोटे टुकड़ों में विभाजित करता है। गाइड स्ट्रैंड के रूप में ज्ञात टुकड़े के दो स्ट्रैंड में से एक को तब आरएनए-प्रेरित सायलेंसिंग कॉम्प्लेक्स (RISC) में निगमित किया जाता है। अध्ययन का सबसे अच्छा परिणाम पोस्ट ट्रांस्क्रिप्शनल जीन सायलेंसिंग है, जो तब पैदा होता है जब गाइड स्ट्रैंड बेस मैसेंजर आरएनए अणु के संपूरक क्रम के साथ जुड़ता है और दरार को आर्गोनॉट, आरआइएससी कॉम्प्लेक्स का एक कैटालिटिक घटक, के द्वारा प्रेरित करता है। इसे siRNA के शुरूआती रूप में सीमित दाढ़ सांद्रता को छोड़कर दैहिक रूप से सभी जीवधारियों में फैल जाने वाली प्रक्रिया के रूप में जाना जाता है।
जीन अभिव्यक्ति पर dsRNA का चयनित औप मजबूत प्रभाव इसे एक महत्वपूर्ण शोध बना देता है, कोशिका कल्चर और सजीव प्राणी होनों में ही क्योंकि कोशिका में दाखिल सिंथेटिक dsRNA रूचि के विशेष जीनों के दबाव को प्रेरित कर सकता है। RNAi भारी पैमाने के स्क्रीन के लिए भी उपयोग में लाया जा सकता है जो योजनाबद्ध तरीके से प्रत्येक जीन को कोशिका में बंद कर सकता है, जो एक विशेष कोशिकीय प्रक्रिया या कोशिका विभाजन की घटना के लिए जरूरी घटकों की पहटान में सहायता कर सकता है। इस मार्ग का उपयोग जैवप्रौद्योगिकी और औषधि के लिए एक आशाजनक उपकरण हो सकता है।
ऐतिहासिक रूप से, आरएनए हस्तक्षेप को पोस्ट ट्रांस्क्रिप्शनल जीन सायलेंसिंग और क्वेलिंग की तरह ही अन्य नाम से जाता जाता था। इन स्पष्टतया असंबंधित प्रक्रियाओं को पूरी तरह से समझ लेने के बाद ही यह साफ हो पाया कि ये सभी RNAi के ही तथ्य को व्याख्यायित करते हैं। 2006 में, एंड्रयू फायर और क्रेग सी. मेलो ने फजियोलॉजी या औषधि में नोबल पुरस्कार प्राप्त किया, यह पुरस्कार निमैटोड वॉर्म सी. एलेगेन्स में आरएनए हस्तक्षेप पर उनके काम के लिए दिया गया,[१] जिसे उन्होंने 1998 में प्रकाशित किया।[२]
कोशिकीय तंत्र

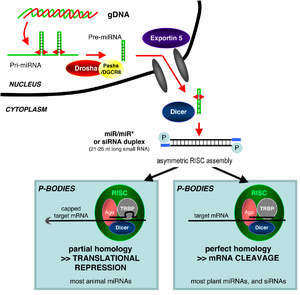
आरएनएआई (RNAi) एक आरएनए-आश्रित जीन सायलेंसिंग प्रक्रिया है जिसे आरएनए-प्रेरित सायलेंसिंग कॉम्प्लेक्स (RISC) द्वारा नियंत्रित किया जाता है और जिसे लघु दुगना-धंसे हुए आरएनए अणुओं द्वारा कोशिका के साइटोप्लाज्म में शुरू किया जाता है, जहां वे कैटलिटिक आरआईएससी घटक आर्गोनॉट के साथ अंत:क्रिया करते हैं।[१] जब dsRNA एक्सोजेनस (आरएनए जिनॉम युक्त एक वायरस द्वारा संक्रमण या प्रयोगशाला की गड़बड़ी से आकर) होते हैं, तब आरएनए को सीधे साइटोप्लाज्म में आयातित किया जाता है और एंजाइम डिसर द्वारा छोटे टुकड़ों में विभाजित कर दिया जाता है। dsRNA की शुरूआत एंडोजेनस (कोशिका में पैदा होना) भी हो सकती है जैसे (भी किया जा सकता है अंतर्जात मूल कोशिका में), microRNA-के रूप में पूर्व जीन कोडिंग-s व्यक्त की शाही सेना से जीनोम में है। इस तरह के जीन के प्राथमिक ट्रांस्क्रिप्ट नाभिक में पूर्व-miRNA के अभिलक्षणिक स्टेम-लूप संरचना के निर्माण की पहली प्रक्रिया होते हैं, इसके बाद वे डिसर के द्वारा विभाजित किए जाने के लिए साइटोप्लाज्म में भेजे जाते हैं। इस प्रकार, दो dsRNA रास्ते, एक्सोजेनस और एंडोजेनस रिस्क (RISC) कॉम्प्लेक्स की ओर जाते हैं।[४]
डीएसआरएनए (dsRNA) दरार
अंतर्जात (एंडोजेनस) रिबोन्युक्लीएज प्रोटीन डिसर को सक्रिय कर के RNAi की शुरुआत करते है,[५] जो हर छोर पर कुछ बिना जोड़ी के झुके हुए 21-25 आधार जोड़े के दुगने-धंसे हुए टुकड़ों का निर्माण करने के लिए दुगने-धंसे हुए RNAs (dsRNA) को बांधते और विभाजित करते हैं।[६][७][८][९] कई जीवों के जीनोम पर बायोइनफॉरमैटिक्स अध्ययन का सुझाव है की यह लम्बाई लक्ष्य-जीन विशिष्टता को अधिकतम सीमा तक बढ़ाती और गैर-विशिष्ट प्रभावों को न्युनतम बनाती है।[१०] इन छोटे दुगने-धंसे हुए टुकड़ों को लघु हस्तक्षेपक एसआईआरएनएएस (siRNAs) कहा जाता है। इसके बाद ये siRNAs एकल स्ट्रैंड में विभाजित किए जाते हैं और एक सक्रिय आरआईएससी (RISC) कॉम्प्लेक्स में एकीकृत किए जाते हैं। आरआईएससी (RISC) में एकीकरण के बाद, siRNAs आधार-जोड़े से उनके लक्ष्य mRNA और mRNA के प्रेरित दरार, के फलस्वरूप इसे रुपांतरण टेंपलेट के रूप में उपयोग किए जाने से रोकता है।[११]
एक्सोजेनस dsRNA को, सी. एलेगेन्स में आरडीई-4 और ड्रोसोफिला में R2D2 के रूप में ज्ञात एक प्रभावोत्पादक प्रोटीन के द्वारा पहचाना और परिसिमित किया जाता है, जो डिसर की गतिविधि को उद्दीप्त करता है।[१२] यह प्रोटीन केवल लंबे dsRNAs को परिसीमित करता है, लेकिन इस लंबाई विशिष्टता का निर्माण करने वाली प्रणाली अज्ञात है।[१२] ये आरएनए-बाइंडिंग प्रोटीन तब विभाजित siRNA से RISC कॉम्प्लेक्स में स्थानांतरण को सुगम बना देते हैं।[१३]
सी. एलेगेंस में, यह शुरूआत प्रतिक्रिया को कोशिका के द्वारा डिसर-उत्पादित शुरूआत या टेंपलेट के रूप में 'प्राथमिक' siRNAs का उपयोग करते हुए द्वितीयक siRNAs की एक जनसंख्या के संश्लेषण के द्वारा फैलाया जाता है।[१४] ये siRNAs संरचनात्मक रूप से डिसर-उत्पादित siRNAs से पृथक होते हैं और एक आरएनए-आश्रित आरएनए पोलिमिरेज (RdRP) द्वारा उत्पादित हुए लगते हैं।[१५][१६]
माइक्रोआरएनए
साँचा:main माइक्रोआरएनए (miRNAs) जिनॉमिक रूप से कोडित किए गए नॉन-कोडिंग RNAs होते हैं जो जीन अभिव्यक्ति को, विशेष रूप से विकास के दौरान, विनियमित करते हैं।[१७][१८] व्यापक रूप से परिभाषित, आरएनए हस्तक्षेप की घटना में miRNAs के अंतर्जात रूप से प्रेरित जीन सायलेंसिंग प्रभाव के साथ ही बाहरी dsRNA द्वारा सक्रिय की गई सायलेंसिंग भी शामिल है। परिपक्व miRNAs संरचनात्मक रूप से एक्सोजेनस से उत्पादित siRNAs के समान होते हैं, लेकिन परिपक्व होने के पहले miRNAs को सबसे पहले व्यापक पोस्ट-ट्रांस्क्रिप्शनल संशोधन से जरूर गुजरना चाहिए। miRNA को पीआरआई-एमआईआरएनए के रूप में ज्ञात एक प्राथमिक ट्रांस्क्रिप्ट के रूप में एक बहुत लंबे आरएनए-कोडिंग जीन से अभिव्यक्त किया जाता है जिसे माइक्रोप्रोसेसर कॉम्प्लेक्स के द्वारा, कोशिका नाभिक में, एक प्री-एमआईआरएनए नामक एक 70-न्युक्लीओटाइड स्टेम-लूप संरचना तक प्रसंस्कृत किया जाता है। यह कॉम्प्लेक्स ड्रोशा नामक एक RNase III एंजाइम और एक डीएसआरएनए-बाइंडिंग प्रोटीन पाशा से बना होता है। पूर्व- miRNA का यह dsRNA भाग परिपक्व miRNA अणु पैदा करने के लिए डिसर द्वारा बाउण्ड और विभाजित किया जाता है जिसे RISC कॉम्प्लेक्स में एकीकृत किया जा सकता है; इस प्रकार, miRNA और siRNA प्रवाह की ओर अपने शुरूआती प्रोसेसिंग में उसी कोशिकीय मशीनरी को शेयर करते हैं।[१९]
लंबे dsRNA प्रीकर्सर से व्युत्पन्न siRNAs उन miRNAs से भिन्न मिर्नस है, विशेषकर उनसे जो पशुओं में होते हैं, जिनमें लक्ष्य को लिए अधूरे आधार जोड़ होते हैं और जो समान क्रमयुक्त बहुत सारे mRNAs के रूपानंतरण को रोकते हैं। इसके विपरीत, siRNAs आम तौर पर पूर्ण पूप से बेस-पेयर बनाते हैं और केवल एक एकल, निश्चित लक्ष्य में mRNA दरार को प्रेरित करते हैं।[२०] ड्रोसोफिला और सी. एलेगन्स में, miRNA और siRNA सुनिश्चित आर्गोनॉट प्रोटीन और डिसर एंजाइम द्वारा प्रसंस्कृत किए जाते हैं।[२१][२२]
आरआईएससी (RISC) सक्रियण और कटैलिसीस
एक आरएनए-प्रेरित सायलेंसिंग कॉम्प्लेक्स के सक्रिय घटक लक्ष्य एंडोन्युक्लीएज होते हैं जिन्हें आर्गोनॉट प्रोटीन कहा जाता है जो उनके बाउण्ड siRNA से अन्योनाश्रित लक्ष्य mRNA स्ट्रैंड को विभाजित करते हैं।[१] चूंकि डिसर द्वारा उत्पादित टुकड़े डबल-स्ट्रैंडेड होते हैं, सिद्धातत: वे सभी एक कार्यात्मक siRNA हो सकते हैं। हालांकि, दो में से केवल एक स्ट्रैंड, जिसे गाइड स्ट्रैंड के रूप में जाना जाता है, आर्गोनॉट प्रोटीन को बांधते हैं और जीन सायलेंसिंग को निर्देश देते हैं। अन्य एंटी-गाइड स्ट्रैंड या पैसेंजर स्ट्रैंड आईआरएससी सक्रियण के दौरान निम्न कर दिए जाते हैं।[२३] हालांकि पहले यह माना जाता था कि एक एटीपी निर्भर हेलिकेस ने एन दो स्ट्रैड को अलग किया,[२४] लेकिन यह प्रक्रिया वास्तव में एटीपी-निर्भर है और आऱआईएससी के प्रोटीन घटकों द्वारा सीधे-सीधे घटित की जाती है।[२५][२६] गाइड के रूप में चयनित स्ट्रैंड इस तरह का होता है जिसका 5' छोर इसके घटक से बहुत कम जुड़ा होता है,[२७] लेकिन स्ट्रैंड चयन उस न्र्देस के द्वारा अप्रभावी कर दिया जाता है जिसमें आऱआईएससी निगमीकरण के पहले डिसर dsRNA को विभाजित कर देता है।[२८] इसके बजाय, R2D2 प्रोटीन पैसेंजर स्ट्रैंड के अधिक-स्थिर 5' छोर को बांधकर अलगाववादी कारक के रूप में कार्य करता है।[२९]
आरएन को आर्गोनॉट प्रोटीन से बांधने के लिए संरचनात्मक आधार को एक आरएनए-बाउण्ड आर्गोनॉट प्रोटीन के बाइंडिंग डोमेन के एक्स-रे क्रिस्टलोग्राफी द्वारा परीक्षित किया गया। यहां, आरएनए स्ट्रैंड का फॉस्फोयुक्त 5' छोर एक संरक्षित आधारभूत सरफेस पॉकेट में प्रवेश करता है और एक डीवैलेंट कैशन (दो धनात्मक चार्ज वाला एक परमाणु) से संपर्क बनाता है जैसे कि मैगनिशियम और यह संपर्क वह siRNA के 5' नियुक्लिओटॉयड और संचित टाइरोसाइन अवशेष के बीच अरोमेटिक स्टेकिंग (एक प्रक्रिया जो एक से अधिक परमाणु को आगे और पीछे कर के एक इलेक्ट्रान शेयर करने की अनुमति देती है) द्वारा करता है। इस साइट का विचार था कि siRNA को इसके mRNA से बांधने के लिए एक न्युक्लिएशन का निर्माण किया जाए.[३०]
यह समझ में नहीं आता है कि कैसे सक्रिय RISC कॉम्प्लेक्स कोशिका के भीतर पूरक mRNAs को अवस्थित करता है। हालांकि विपाटन प्रक्रिया को रूपांतरण से जोड़ने के लिए प्रस्तावित किया गया है लेकिन mRNA का रूपांतरण RNAi-मेडिएटेड क्षरण के लिए आवश्यक नहीं है।[३१] दरअसल, आरएनएआई mRNA लक्ष्य के विरूद्ध बहुत प्रभावशाली हो सकती है जिनका रूपांतरण नहीं किया जाता.[३२] आर्गोनॉट प्रोटीन, RISC के उत्प्रेरक घटकों को पी-बॉडी (साइटोप्लाज्मिक बॉडी या जीडब्ल्यू बॉडी भी) के नाम से ज्ञात साइटोप्लाज्म के विशेष क्षेत्रों में अवस्थित किया जाता है, जो mRNA के तीव्र क्षरण दर वाले क्षेत्र होते हैं,[३३] miRNA गतिविधि को भी क्लस्टर कर दिया जाता है।[३४] पी-बॉडी का विघटन आरएनए हस्तक्षेप की क्षमता को कम कर देता है, यह सुझाव देते हुए कि ये RNAi प्रक्रिया में एक जटिल कदम वाले साइट हैं।[३५]
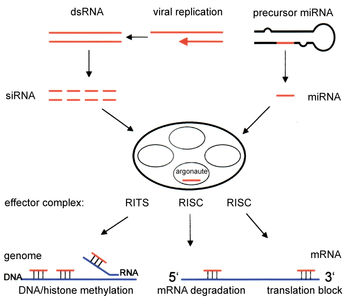
ट्रांसक्रिप्शनल सायलेंसिंग
आरएनए हस्तक्षेप मार्ग घटकों का उपयोग बहुत सारे युक्रॉयट में संगठन और उनके जिनॉम संरचना की मरम्मत में किया जाता है। हिस्टोन्स का संशोधन और हेट्रोक्रोमैटिन निर्माण का संबंधित प्रेरण जीन को पूर्व-लिप्यन्तरणता से डाउनरेगुलेट करमे में सहायता करता है,[३७] इस प्रक्रिया को आरएनए-प्रेरित ट्रास्क्रिप्शनल सायलेंसिंग (RITS) के रूप में संदर्भित किया जाता है और यह प्रक्रिया RITS नामक प्रोटीन के एक कॉम्प्लेक्स द्वारा संपन्न की जाती है। विखंडन यीस्ट के इस कॉम्प्लेक्स में आर्गोनॉट, एक क्रोमोडोमेन प्रोटीन सीएचपी1 और अज्ञात कार्य करने वाला Tas3 प्रोटीन रहते हैं।[३८] परिणाम के रूप में, हेट्रोक्रोमेटिक क्षेत्रों के प्रेरण और विस्तार के लिए आर्गोनॉट और RdRP प्रोटीन की जरूरत होती है। वास्तव में कोशिका विभाजन के समय,[३९] धीमा या विलंब एनोफेज के कारण, यीस्ट विखण्डन एस.पौंबे में इन जीनों का विलोप हिस्टोन मिथाइलेशन और सेंट्रोमियर निर्माण को बाधित करता है।[४०] कुछ मामलों में, हिस्टोन संशोधन से जुड़ी इसी तरह की प्रक्रियाओं को, लिप्यंतरणता अपरेगुलेट जीन के लिए देखा गया है।[४१]
वह तंत्र जिसके द्वारा RITS कॉम्प्लेक्स हेट्रोक्रोमैटिन निर्माण और संगठन को प्रेरित करता है उसे सही तरीके से नहीं समझा गया है और अधिकतर अध्ययनों ने अपना ध्यान विखण्डन यीस्ट के मेटिंग-टाइप क्षेत्र पर केन्द्रित किया है, जो अन्य जिनॉमिक क्षेत्रों या जीवधारियों की गतिविधियों का प्रतिनिधि नहीं भी हो सकता है। मौजूदा हेट्रोक्रोमौटिन क्षेत्रों के रखरखाव में, लोकल जीन के पूरक के रूप में RITS एक siRNAs युक्त कॉम्प्लेक्स का निर्माण करता है और स्थिर रूप से लोकल मिथाइलेटेड हिस्टोन्स को बांधता है और यह कार्य वह किसी नैसेंट पूर्व-एमआरएनए ट्रांस्क्रिप्ट, जो आरएनए पॉलिमिरेज द्वारा शुरू किए जाते हैं, को क्षरित करने के लिए सह-लिप्यंतरणता से कार्य करते हुए करता है। इस तरह के हेट्रोक्रोमैटिन क्षेत्र का एक गठन, हालांकि, इसका रखरखाव नहीं, डिसर-आश्रित होता है, संभवत: इस कारण कि डिसर को siRNAs के शुरूआती घटकों के निर्माण की जरूरत पड़ती है जो अनुवर्ती ट्रांस्क्रिप्ट को लक्ष्य बनाते हैं।[४२] हेट्रोक्रोमैटिन रखरखाव को स्वयं-सुदृढ़ फिडबैक लूप के रूप में कार्य करने का सुझाव दिया जाता है क्योंकि नए siRNAs अनियत नवजात ट्रांस्क्रिप्ट से लोकल RdRP में निगमन के लिए RdRP द्वारा गठित किया जाता है।[४३] स्तनपायियों के लिए विखंडन यीस्ट मेटिंग-टाइप क्षेत्र और सेंट्रोमियर से प्राप्त अवलोकन के परिणाम स्पष्ट नहीं हैं, क्योंकि स्तनपायी कोशिकाओं में हेट्रोक्रोमैटिन रखरखाव RNAi मार्ग के घटकों से स्वतंत्र हो सकते हैं।[४४]
आरएनए संपादन के साथ जिरह
आरएनए संपादन के प्रकार जो उच्च युक्रॉयोट में बहुत प्रचलित हैं एंजाइम एडेनोसाइन डीमिनेज (ADAR) से होकर dsRNA में एडेनोसाइन न्युक्लियोटाइड को इनोसाइन में बदलता है।[४५] यह मूल रूप से 2000 में प्रस्तावित किया गया था कि RNAi और A→I RNA संपादन मार्ग एक साधारण dsRNA की प्रतिस्पर्धा कर सकते हैं।[४६] वास्तव में, कुछ पूर्व- miRNAs A→I RNA संपादन से जरूर गुजरते हैं,[४७][४८] और यह प्रणाली परिपक्व iRNAs की प्रक्रिया और अभिव्यक्ति को विनियमित कर सकती है।[४७] इसके अलावा, कम से कम एक स्तनधारी ADAR आरएनएआई मार्ग घटकों को siRNAs से पृथक कर सकता है।[४९] इसके अलावा इस मॉडल के लिए समर्थन ADAR -नुल्ल सी. एलेगन स्ट्रेन्स के अध्ययन से मिलता है, जो यह संकेत देता है कि A→I RNA संपादन एंडोजेनस जीन और ट्रांसजीन के RNAi सायलेंसिंग को उलट सकता है।[५०]
जीवों के बीच में भिन्नता
जीवों में विदेशी dsRNA ग्रहण करने और आरएनएआई मार्ग में इसके उपयोग करने की क्षमता में भिन्नता होती है। आरएनए हस्तक्षेप का प्रभाव पौधों और सी.एलेगन में प्रणालीगत और पैतृक होनों हो सकता है, हलांकि यह ड्रोसोफोलिया या स्तनपायियों में नहीं हो सकता. पौधों में, आरएनएआई कोशिकाओं के बीच siRNAs के स्थानांतरण द्वारा प्लाज्मोडेजमेटा (कोशिका दीवारों की वाहिकाएं जो संचार और परिवहन को समर्थ बनाती हैं) के माध्यम से फैलाया जाता है।[२४] हैरेटिबिलटी आरएनएआई द्वारा लक्षित प्रमोटरों के मिथाइलेशन आता है, नए मिथाइलेशन पैटर्न कोशिका की प्रत्येक नई पीढ़ी में प्रतिरूपित किया जाता है।[५२] पौधों और जानवरों के बीच एक व्यापक सामान्य भेद अंतर्जातिक रूप से उत्पादित miRNAs के लक्ष्यीकरण में निहित होता है; पौधों में, miRNAs आमतौर पर पूरी तरह से या लगभग पूरी तरह से उनके लक्ष्य जीन के पूरक होते हैं और आईआईएससी द्वारा विभाजित प्रत्यक्ष एमआरएनए को प्रेरित करते है, जबकि पशुओं के miRNAs क्रम में अधिक भिन्न रूख वाले होते हैं और रूपांतरणीय दमन को प्रेरित करते हैं।[५१] इस रूपांतरणीय प्रभाव को मैसेंजर आरएनए के पॉलिएडेमाइन टेल युक्त रूपांतरण प्रवर्तन कारक की अंत:क्रिया को रोक कर उत्पादित किया जा सकता है।[५३]
कुछ यूकैरिओटिक प्रोटोजोआ जैसे कि लेशमेनिया मेजर और ट्राइपेनोसोमा क्रुजी में आरएनएआई मार्ग का पूरी तरह से अभाव होता है।[५४][५५] अधिकांश या सभी घटक कवक, बहुत विख्यात मॉडल जीव सैक्रोमाइसेज सेरेविजिआ, में नदारद रहते हैं।[५६] हाल के अध्ययन तथापि, अन्य बडिंग यीस्ट प्रजातियों, जैसे कि सैक्रोमाइसेज कास्टेल्ली और कैंडिडा एल्बिकन्स, में आरएनएआई की उपस्थिति को प्रकट करते हैं, तत्पश्चात यह दर्शाते हैं कि एस.कास्टेल्ली के दो आरएनआई-युक्त प्रोटीन का प्रेरण एस.सेरेविजिआ में आरएनएआई को सुगम बनाता है।[५७] चूंकि कुछ एस्कोमाइसेट्स और बैसिडियोमाइसेट्स में आरएनए मार्ग की अनुपस्थिति यह संकेत करता है कि आरएनए सायलेसिंग के लिए जरूरी प्रोटीन, संभवत: समान कार्य वाले एक नए मार्ग के विकास के कारण, या कुछ स्थानों में चयनित लाभ के अभाव के कारण, बहुत सारे फंगल लिनिएज से स्वतंत्रतापूर्वक खो दिए गए हैं।[५८]
संबंधित प्रोकार्योटिक प्रणालियां
प्रोकार्योट्स में जीन एक्सप्रेशन कुछ हद तक आरएनआई के सामान एक आरएनए-आधारित प्रणाली द्वारा प्रभावित होता है। यहां, आरएनए-इनकोडिंग जीन एमआरएनए बहुलता या रूपांतरण को एक पूरक आरएनए के उत्पादन द्नारा नियंत्रित करता है जो एक बेस-पेयरिंग द्वारा एमआरएनए से बंधा होता है। हालांकि इन विनियामक आरएनए को साधारणत: miRNAs के अनुरूपता के रूप में जाना जाता है क्योंकि इसमें ज्सर एंजाइम शामिल नहीं होते.[५९] यह सुझाव दिया गया है कि प्रोकार्योट्स में सीआरआईएसपीआर हस्तक्षेप प्रणाली युकार्योटिक आरएनए हस्तक्षेप के अनुरूप होती है, हलांकि प्रोटीन के घटकों में से कोई भी आर्थोलोगस नहीं होता। [६०]
जैविक प्रकार्य
प्रतिरक्षा
आरएनए हस्तक्षेप वायरस और अन्य विदेशी जेनेटिक पदार्थों के लिए इम्युन प्रतिक्रिया का एक महत्वपूर्ण भाग हो सकता है, विशेषकर उन पौधों में जहां यह ट्रांसपोसोन के द्वारा स्व-विस्तार को रोक सकता है।[६१] एराबिडोप्सिस थालिआना जैसे पौधे बहु होमोलॉग डिसर को अभिव्यक्त करते हैं जिन्हें भिन्न तरीके से प्रतिक्रिया करने के लिए विशेषीकृत किया जाता है जब पौधों को विभिन्न प्रकार के वायरस के लिए अनावृत किया जाता है।[६२] आरएनएआई मार्ग को पूरी तरह समझने के पहले भी यह ज्ञात था कि पौधों में प्रेरित जीन सायलेंसिंग पूरे पौधे में एक प्रणालीगत प्रभाव के साथ फैल सकती है और ग्राफ्टिंग की मार्फत स्टॉक से सियोन पौधों में स्थानांतरित की जा सकती है।[६३] इस फिनोमेना को तब से प्लांट एडाप्टिव इम्युन सिस्टम की विशेषता रूप में पहचाना जाता रहा है और यह फिनोमेना सारे पौधों को एक प्रारंभिक स्थानीकृत मुटभेड़ के बाद वायरस से प्रतिक्रिया करने की अनुमति देती है।[६४] प्रतिक्रिया में, कई पादप वायरस ने विस्तृत मेकनिज्म विकसित कर ली है जो पादप कोशिकाओं में आरएनएआई प्रतिक्रिया को दमित करती है।[६५] इनमें वायरल प्रोटीन भी शामिल हैं जो एकल-स्ट्रेंडेड छज्जा छोर युक्त डबल-स्ट्रेंडेड आरएनए चुकड़ों को बांधता है, वैसे ही जैसे डिसर की क्रिया द्वारा उत्पादित वस्तुओं के साथ.[६६] कुछ पादप जिनॉम्स भी बैक्टेरिया के विशेष प्रकारों द्वारा संक्रमण की प्रतिक्रिया में एंडोजेनस siRNAs को अभिव्यक्त करते हैं।[६७] ये प्रभाव पैथोजेन के प्रति सामान्यीकृत प्रतिक्रिया के भाग हो सकते हैं जो संक्रमण प्रक्रिया की सहायता करने वाले मेजबान की किसी भी मेटाबोलिक प्रक्रिया को डाउनरेगुलेट करते हैं।[६८]
हालांकि आम तौर पर पौधों की अपेक्षा जानवर डिसर एंजाइम के कुच कम वेरिएंट को प्रकट करते हैं, कुछ जानवरों में आरएनएआई को एक एंटिवायरल प्रतिक्रिया पैदा करने वाले के रूप में दिखाया गया है। जुवेनिले और व्यस्क ड्रोसोफिला दोनों ही में, आरएनए हस्तक्षेप एंटिवायरल अंतर्जात प्रतिरक्षा में महत्वपूर्ण होता है और ड्रोसोफिला एक्स वायरस जैसे फोटोजेन के खिलाफ सक्रिय रहता है।[६९][७०] प्रतिरक्षा की इसी तरह की भूमिका सी.एलेगन्स में भी संचालित की जा सकती है, क्योकि आर्गोनॉट प्रोटीन वायरस और कीड़ों की प्रतिक्रिया में अपरेगुलेट किए जाते हैं जो आरएनएआई मार्ग के घटकों को ओवरएक्सप्रेस करते हैं और ये वायरल संक्रमण के प्रतिरोधी होते हैं।[७१][७२]
स्तनधारी अंतर्जात प्रतिरक्षा में आरएनए हस्तक्षेप की भूमिका को बहुत कम समझा गया है और अपेक्षाकृत बहुत कम आकड़ा उपलब्ध है। बहरहाल, वायरस की मौजूदगी, जो स्तनधारी की कोशिकाओं की आरएनएआई प्रतिक्रिया को दबाने में सक्षम जीन को इनकोड करती है, एक आरएनएआई-आश्रित स्तधारी इम्युन प्रतिक्रिया के पक्ष में साक्ष्य हो सकती है।[७३][७४] हालांकि, स्तनधारियों में आरएनएआई-मध्यस्थता प्रतिरक्षा की इस परिकल्पना को खराब प्रमाण के रूप में चुनौती दी गई है।[७५] स्तनधारी वायरस में आरएनएआई के लिए वैकल्पिक कार्य भी मौजूद रहते हैं, जैसे कि हर्पीज वायरस द्वारा अभिव्यक्त miRNA, जो वायरल विलंबता की मध्यस्थता के लिए हेट्रोक्रोमैटिन संगठन ट्रिगर के रूप में कार्य कर सकते हैं।[४१]
जीन के डाउनरेगुलेशन
इंट्रोनिक और इंटरजेनिक miRNAs दोनों को शामिल करते हुए सहज रूप से अभिव्यक्त miRNAs, रूपांतरणता दबाव में बहुत महत्वपूर्ण होते हैं,[५१] और विकास के विनियमन में, विशेषकर स्टेम कोशिकाओं जैसी एक सी या पूरी तरह से भिन्न कोशिका प्रकारों के रखरखाव और मार्फोजेनेसिस में भी ये महत्वपूर्ण होते हैं।[७६] जीन अभिव्यक्ति को डाउनरेगुलेट करने में सहज रूप से अभिव्यक्त miRNA की भूमिका को पहली बार सी. एलेगन्स में 1993 में व्याख्यायित किया गया।[७७] पौधों में इस कार्य को तब खोजा गया जब एराबिडोप्सिस के "JAW माइक्रो RNA" को पौधे के आकार को नियंत्रित करने वाले विभिन्न जीनों के विनियमन में शामिल होने के रूप में दर्शाया गया।[७८] पौधों में, miRNAs द्वारा विनियमित जीनों की बहुलता ट्रांस्क्रिप्शन कारक होते हैं,[७९] इस प्रकार miRNA गतिविधि विशेष रूप से व्यापक पहुंच वाली होती है और विकास के दौरान पूरे जीन नेटवर्क को, एफ-बॉक्स प्रोटीन के साथ ही ट्रांस्क्रिप्शन कारकों को शामिल करते हुए कुंजी निनियामक जीन की अभिव्यक्ति को ठीक कर के करती है।[८०] मनुष्य के साथ ही बहुत सारे जीवों में, miRNAs को भी ट्यूमर के निर्माण और कोशिका चक्र के अविनियमन के साथ जोड़ा गया है। यहाँ, miRNAs ऑनकॉग्जीनेस और टूयूमर शमक दोनों के रूप में कार्य करता है।
जीनों का अपरेगुलेशन
आरएनए अनुक्रम (siRNA और miRNA) जो प्रमोटर के भागों के पूरक होते हैं, जीन ट्रांस्क्रिप्शन, एक मिनोमेना द्वारा डब किए गए आरएनए सक्रियण को बढ़ा सकता है। ये आरएनए जीनों को कैसे अपरेगुलेट करते हैं, उस प्रणाली का एक भाग ज्ञात है: डिसर और आर्गोनॉट शामिल रहते हैं और हिस्टोन डीमिथाइलेशन होता है।
विकास
पार्समोनी-आधारित फिलोजेनेटिक विश्लेषण पर आधारित, सभी यूकार्योट्स के सबसे हाल के आम पूर्वज बहुत संभवत: पहले ही शुरूआती आरएनए हस्तक्षेप को भूतग्रस्त करते थे, कुछ युकार्योट्स में मार्ग की अनुपस्थिति को व्युत्पन्न विशेषता माना जाता था।[८१] यह पैतृक आरएनएआई सिस्टम में शायद कम से कम एक डिसर जैसा प्रोटीन, एक आर्गोनॉट, एक पीआईडब्ल्यूआई प्रोटीन और एक आरनए-आश्रित आरएनए पॉलिमिरेज निहित होते हैं जो अन्य कोशिकीय भूमिका भी निभा चुके होते हैं। इसी तरह एक बड़े पैमाने पर तुलनात्मक जीनोमिक्स अध्ययन इंगित करता है कि युकार्योट ताज समूह पहले से इन धटकों को अपने वश में रखते हैं, जो एक्सोसोम जैसे सामान्यीकृत आरएनए गिरावट के साथ करीब संबंध रख चुके हो सकते हैं।[८२] इस अध्ययन से यह भी पता चलता है कि आरएनए- बाइंडिंग आर्गोनॉट प्रोटीन परिवार, जिसे युकार्योट्स, सबसे अधिक आर्काइआ और कम से कम कुछ बैक्टेरिया (जैसे कि एक्विफेक्स एओलिकस) के बीच साझा किया जाता है, वे होमोलोगस होते हैं और मूल रूप से ट्रांस्लेशन इनिसिएशन सिस्टम से विकसित किए जाते हैं।
आरएनएआई प्रणाली के पैतृक कार्य में आम तौर पर ट्रांसपोसोन्स और वायरल जिनॉम जैसे एक्सोजेनस जेनेटिक तत्वों के खिलाफ इम्युन रक्षा के होने पर सहमति है।[८१][८३] हिस्टोन संशोधन जैसे संबंधित कार्य आधुनिक युकार्योट के पूर्वजोम में पहले से ही मौजूद रहे हो सकते हैं, हालांकि miRNA द्वारा विनियमन के विकास जैसे अन्य कार्य बाद में विकसित हुए माने जाते हैं।[८१]
कई युकार्योट्स में एंटिवायरल अंतर्जात इम्युन के घटकों के रूप में, आरएनए हस्तक्षेप जीन वायरल जीनों के साथ एक निकासमूलक हथियारों की होड़ में शामिल रहते हैं। कुछ वायरस अपनी मेजबान कोशिकाओं की आरएनएआई प्रतिक्रिया, एक प्रभाव जिसे व्शेष तौर पर पादप वायरसों के लिए उल्लिखित किया जाता रहा है, को दबाने के लिए प्रणालियां विकसित कर चुके हैं।[६५] ड्रोसोफिला में विकास दर के अध्ययन ने यह बताया है कि आरएनएआई मार्ग में जीन मजबूत दिशात्मक चयन होते हैं और ड्रोसोफिला जिनॉम में सबसे तेज विकसित होने वाले जीनों में होते हैं।[८४]
तकनीकी अनुप्रयोग
जीन नॉकडाउन
आरएनए हस्तक्षेप मार्ग को प्रयोगात्मक जीविज्ञान में प्राय: कोशिका कल्चर और मॉडल जीवों के इन वीवो में जीन के कार्यों के अध्ययन के लिए प्रयोग में लाया जाता है।[१] डबल-स्ट्रेंडेड आरएनए को रूचि के जीन के पूरक क्रम के साथ संश्लेषित किया जाता है और एक कोशिका या जीव में प्रवेश कराया जाता है, जहां यह एक्सोजेनस जेनेटिक मेटेरियल के रूप में पहचाना जाता है और आरएनएआई मार्ग को सक्रिय करता है। इस यंत्रावली का उपयोग करते हुए, शोधकर्ता एक लक्षित जीन की अभिव्यक्ति में भारी कमी पैदा कर सकते हैं। इस कमी के प्रभाव का अध्ययन जीन उत्पाद के शरीरवैज्ञानिक भूमिका को दर्शा सकता है। चूंकि आरएनएआई जीन की अभिव्यक्ति को पूरी तरह से समाप्त नहीं कर सकती, इसलिए इस तकनीक को कभी-कभी "नॉकडाउन" के रूप में संदर्भित किया जाता है, यह "नॉकआउट" प्रक्रिया से इसे अलग करने के लिए किया जाता है जिसमें जीन की अभिव्यक्ति पूरी तरह समाप्त कर दी जाती है।[८५]
कम्प्यूटेशनल जीव विज्ञान के व्यापक प्रयासों को सफल dsRNA अभिकर्मकों के डिजाईन की ओर निर्देशित किया जाता है जो जीन नॉकडाउन को अधिकतम और "ऑफ-टारगेट" प्रभावों को न्युनतम करता है। ऑफ-टारगेट प्रभाव तब पैदा होता है जब एक चिन्हित आरएनए में आधार अनुक्रम होता है जो एक ही समय कई जीनों की अभिव्यक्ति के साथ जुड़ता है और इस प्रकार इसे कम करता है। इस तरह की समस्याएं बार-बार होती हैं, जब dsRNA में दोहरावदार क्रम शामिल रहते हैं। एच. सेपिअन्स, सी. एलेगन्स और एस. पॉम्बे के जिनॉम्स के अध्ययन से यह अनुमान लगाया गया है कि लगभग 10% संभव siRNAs के पास पर्याप्त ऑफ-टारगेट प्रभाव होगा। [१०] सॉफ्टवेयर उपकरणों के एक जमावड़े का विकास साधारण,[८६][८७] स्तनपायी-जाति भेदक और वायरस-जाति-भेदक[८८] siRNAs के डिजाईन के लिए एल्गोरिथ्म का कार्यान्वयन करते हुए किया गया है, संभव क्रॉस-रिएक्टिविटि के लिए जिनकी जांच की जाती है।
जीव और प्रायोगिक प्रणाली के आधार पर, एक्सोजेनस को डिसर द्वारा अलग करने के लिए लंबा स्टैंड डिजाईन किया जा सकता है, या छोटे RNAs को siRNA अध:स्तर के रूप में सुरक्षित करने के लिए डिजाईन किया जा सकता है। अधिकतर स्तनपायी कोशिकाओं में, छोटे RNAs उपयोग में लाये जाते हैं क्योंकि डबल-स्ट्रेंडेड आरएनए, अणु स्तनपायी इंटरफेरॉन प्रतिक्रिया; सहज प्रतिरक्षा का एक रूप जो विदेशी जेनेटिक पदार्थों के साथ अमहत्वपूर्ण ढंग से प्रतिक्रिया करता है, को प्ररित करते हैं।[८९] माउस ऊसाइट्स और प्रारंभिक चूहा भ्रूणों की कोशिकाओं में एक्सोजेनस dsRNA के लिए इस प्रतिक्रिया का अभाव होता है, इसलिए वे स्तनपायियों में जीन-नॉकडाउन प्रभाव के अध्ययन के लिए एक आम मॉडल प्रणाली होते हैं।[९०] siRNA के सीधे परिचय की उपेक्षा करते हुए स्तनपायी प्रणालियों में RNAi की उपयोगिता के सुधार के लिए विशिष्ट प्रयोगशाला तकनीकों का भी विकास किया गया है, उदाहरण के लिए, एक उचित अनुक्रम जिससे siRNA को लिप्यंतरित किया जा सकता है,[९१] के प्लाज्मिड इनकोडिंग युक्त स्थिर ट्रांस्फेक्शन द्वारा, या प्रेरणायोग्य सक्रियता या कंडिशनल RNAi के रूप में ज्ञात ट्रांस्क्रिप्शन की निष्क्रियता को अनुमति देते हुए अधिक व्यापक लेंटिवायरल वेक्टर प्रणालियों द्वारा.[९२][९३]
कार्यात्मक जीनोमिक्स

पशुऔं में RNAi के अधिकतर कार्यात्मक जिनॉमिक्स अनुप्रयोग सी.एलेगन्स[९५] और ड्रोसोफिला[९६] का उपयोग कर चुके हैं, क्योंकि ये आम मॉडल जीव हैं जिनमें RNAi सबसे अधिक प्रभावी होता है। सी. एलेगन्स विशेष रूप से RNAi अनुसंधान के लिए दो कारणों से उपयोगी होता है: सबसे पहले जीन सायलेंसिंग के प्रभाव आम तौर पर पैतृक होते हैं और दूसरे क्योंकि dsRNA की प्रसव अत्यंत सरल होता है। एक बहुत कम समझे गए प्रणाली के माध्यम से, बैक्टीरिया, जैसे ई. कोलाई, जो कि वांछित dsRNA को वहन करती है, उसे कीड़ों को खिलाया जा सकता है और वह आंत्र पथ के माध्यम से अपने आरएनए पेलोड को कीड़ों में स्थानांतरित कर सकेगी. यह "खिलाने के द्वारा प्रसव" जीन सायलेंसिंग उत्प्रेरण पर जितना प्रभावी है उससे अधिक खर्चीला और समय की खपत वाला सुपुर्दगी विधि है, जैसे कि dsRNA के घोल में कीड़ों को डुबाना और जनन ग्रन्थि में dsRNA का इंजेक्शन लगाना.[९७] हालांकि प्रसव अधिकतर दूसरे जीवों में अधिक कठिन होता है, फिर भी स्तनपायी कोशिका युक्त कोशिका कल्चर में व्यापक पैमाने पर जिनॉमिक स्क्रिनिंग उपयोगिता के उपक्रम को हाथ में लेने के प्रयास जारी हैं।[९८]
जीनोम-वाइड आरएनएआई लाइब्रेरियों के डिजाइन के प्रयास में, प्रयोगात्मक अवस्था के एक परिभाषित सेट के लिए एक एकल siRNA को डिजाइन करने की अपेक्षा अधिक परिष्करण की जरूरत हो सकती है। siRNA लाइब्रेरी के डिजाइन[९९] और जीन नॉकडाउन में उनकी संभावित क्षमता को बताने में कृत्रिम स्नायु संबंधी नेटवर्कों का बार-बार उपयोग किया जाता है।[१००] मास जीनोमिक स्क्रीनिंग को व्यापक तौर पर जिनॉम की व्याख्या के लिए एक आशाजनक विधि के रूप में देखा जाता है और इसने माइक्रोएरॉय पर आधारित हाई-थ्रुपुट स्क्रिनिंग विधि के विकास को गति दी है।[१०१][१०२] हालांकि, इन स्क्रीन्स की उपयोगिता और गहन रूप से संबंधित प्रजातियों को भी सामान्यीकृत करने के लिए मॉडल जीवों पर विकसित तकनीकों का क्षमता को प्रश्नांकित किया गया है, उदाहरण के लिए सी. एलेगन्स से लेकर संबंधित परजीवीपरक नेमाटोड्स.[१०३][१०४]
आरएनएआई का उपयोग कर कार्यात्मक जीनोमिक्स, जिनॉमिक मानचित्रण और पौधों में एनोटेशन के लिए विशेष रूप से एक आकर्षक तकनीक है क्योंकि बहुत सारे पौधे पॉलीप्लॉयड होते हैं, जो अधिक पारंपरिक जेनेटिक अभियंत्रण विधि के लिए ठोस चुनौती उपस्थित करते हैं। उदाहरण के लिए, ब्रेड गेहूं (जो हेक्सपेलॉयड है)[१०५] के साथ ही अधिक साधारण पादप मॉडल प्रमाली एराबिडोप्सिस और मक्का में कार्यात्मक जिनॉमिक अध्ययन के लिए आरएनएआई का सफलतापूर्वक उपयोग किया गया है।[१०६]
औषधि
थिरेपी में आररएनए हस्तक्षेप का शोषण संभव हो सकता है। हालांकि यह मुश्किल है कि इंटरफेरॉन प्रतिक्रिया के कारण स्तनपायी कोशिकाओं में लंबे dsRNA स्ट्रेंड का प्रवेश हो, फिर भी लघु हस्तक्षेपक आरएनए के प्रतिरूप अधिक सफल रहे हैं।[१०७] मैकुलर क्षरण और श्वास संबंधी सिंसिशिअल वायरस[१०८] के इलाज में चिकित्सकीय परीक्षण तक पहुंचने के लिए प्रथम अनुप्रयोगों में आरएनएआइ को भी माउस मॉडल के प्रेरित लीवर विफलता के वियुत्क्रमण में प्रभावी होना दर्शाया गया था।[१०९]
एंटिवायरल थिरेपी पर अन्य प्रस्तावित चिकित्सकीय उपयोग केन्द्र के साथ ही टोपिकल माइक्रोबाइसाइड चिकित्सा केन्द्र हैं, जो आरएनएआई का उपयोग हर्पस सिंप्लेक्स वायरस प्रकार 2 के द्वारा संक्रमण का इलाज (अब तक चूहे पर, हारवर्ड यूनिवर्सिटि मेडिकल स्कूल) करते हैं और कैंसर संबंधी कोशिकाओं में वायरल जीन अभिव्यक्ति का अवरोधन[११०], एचआइवी के लिए मजबान अभिग्राहक और सहअभिग्राहक को नॉकडाउन[१११], हेपाटाइटिस ए[११२] और हेपाटाइसिस बी जीनों[११३] का सायलेंसिंग, इन्फ्लूएंजा जीन अभिव्यक्ति का सायलेंसिंग[४१], फसरा वायरल प्रतिकृति का अवरोध करते हैं। हटिंगटन के रोगों जैसे पॉलिग्लुटामाइन रोगों पर विशेष ध्यान देते हुए, न्युरोडीजेनरेटिव रोगों के संभावित उपचार को भी प्रस्तावित किया गया है।[११४] ट्यूमर कोशिका में भिन्न रूप में उन्नत जीनों या कोशिका विभाजन में शामिल जीनों के सायलेंसिंग द्वारा कैंसर के इलाज के लिए आरएनए हस्तक्षेप को आशाजनक मार्ग के रूप में देखा जाता है।[११५][११६] नैदानिक अनुप्रयोगों के लिए आरएनएआई के उपयोग में अनुसंधान का प्रमुख क्षेत्र सुरक्षित प्रसव विधि का विकास करना है, जिसमें अब तक जीन थिरेपी के लिए सुझाव दिए गए वे समान वायरल वेक्टर प्रणाली ही शामिल हैं।[११७][११८]
आरएनएआई-आधारित दवाओं के लिए आशाजनक कोशिका कल्चर के अध्ययन के प्रसार के बावजूद, आरएनए हस्तक्षेप की सुरक्षा से जुड़ी कुछ चिंताएं खड़ी की गई हैं, विशेषकर "ऑफ-टारगेट" प्रभाव के लिए क्षमता, जिसमें लक्ष्य की गई जीन के लिए संयोग से समान अनुक्रम युक्त एक जीन को दमित कर दिया जाता है।[११९] एक कम्प्यूटेशनल जीनोमिक्स अध्ययन ने अनुमान लगाया है कि ऑफ-टारगेट अंत:क्रिया का त्रुटि दर लगभग 10% है।[१०] प्रयोगात्मक जानवरों में उच्च मृत्यु दर का नेतृत्व करने वाले चूहों के लीवर के एक प्रमुख अध्ययन, shRNA के उपयोग के कारण जिसका शोधकर्ताओं द्वारा आरएनए मार्ग के अतिसांद्रता के परिणाम रूप में सुझाव दिया गया है, जिसको नाभिक में प्रसंस्करित किया जाना है और उसे एक सक्रिय यंत्रावली का उपयोग कर साइटोप्लाज्म में भेजा जाना है।[१२०] ये सभी विचार हैं जो आरएनएआई के लिए संभावित उपचारात्मक अनुप्रयोगों में उनके प्रभाव को कम करने के लिए सक्रिय जांच के तहत हो रहे हैं।
आरएनए हस्तक्षेप पर आधारित अनुप्रयोगों को लक्ष्य दीर्घस्थायी एचआइवी-1 संक्रमण के लिए विकसित किया जा रहा है। एचआईवी-1 जैसे वायरस आरएनएआई-हमले के लिए विशेष रूप से कठिन लक्ष्य होते हैं क्योंकि वे पलायन-प्रवण होते हैं, जिन्हें वायरल को भागने से रोकने के लिए काँबिनेटोरियल आरएनएआई रणनीति की आवश्यकता होती है। एंटिवायरल आरएनएआई चिकित्सा का भविष्य बहुत आशाजनक है, लेकिन आरएनएआई इंड्युसर्स के स्पष्टतया व्याख्या क्रम-विशेष क्रिया के लिए पूर्व-चिकित्सकीय माडलों में बहुत सारे नियंत्रणों को शामिल करने के लिए यह कठिन महत्वपूर्ण वाला बना रहता है।[१२१]
जैव प्रौद्योगिकी
आरएनए हस्तक्षेप को जैव प्रौद्योगिकी के अनुप्रयोगों में उपयोग किया गया है, विशेषकर खाद्य पौधों में जो पोषक पादप टॉक्सिन के निम्न स्तर का उत्पादन करता है। ऐसी तकनीकें पादप भंडारों में स्थिर और पैत्रिक आरएनएआई फेनोटाइप का लाभ उठाती हैं। उदाहरण के लिए, कपास के दाने खाद्य प्रोटीन के धनी होते हैं लेकिन स्वाभाविक रूप से उनमें मानव खपत के लिए अनुचित बनाता हुआ विषाक्त टरपेनॉयड उत्पाद गॉसीपॉल शामिल रहता है। आरएनएआई का उपयोग कपास भंडार के उत्पादन के लिए किया गया है, जिसके दानों में निम्न स्तर के डेल्टा-कैटिनेन सिन्थेज शामिल रहते हैं, ये गॉसीपॉल उत्पादन में एक कुंजी एंजाइम की तरह हैं जो पौधों के अन्य भागों में एंजाइम उत्पादन को प्रभावित नहीं करते, जहां पौधों की बिमारी से हुए नुकसान को रोकने में गॉसीपॉल महत्वपूर्ण होते हैं।[१२२] ऐसे प्रयासों को कसावा पौधों में सायनोजेनिक प्राकृतिक उत्पादन लिनामैरिन को घटाने की दिशा में निर्देशित किया गया है।[१२३]
हालांकि कोई भी पादप उत्पाद, जो आरएनएआई-आधारित जेनेटिक अभियंत्रण का उपयोग करता है, अब तक प्रयोगात्मक चरण को पार नहीं कर पाया है, फिर भी विकास के प्रयासों ने टमाटर के पौधों में एलर्जेन के स्तर को सफलतापूर्वक कम किया है,[१२४] और तंबाकू के पौधों में संभावित कर्सिनोजेन्स के पूर् लक्षण को घटाया है।[१२५] अन्य पादप लक्षण है जो कि प्रयोगशाला में अभियंत्रित किए गए हैं, उनमें अफीम पोस्ते के द्वारा गैर-मादक प्राकृतिक उत्पाद का उत्पादन,[१२६] आम पादप वायरसों के लिए प्रतिरोध,[१२७] और आहार एंटिऑक्सिडेंट युक्त टमाटर जैसे पौधों का सुदृढ़ीकरण शामिल हैं।[१२८] 0}Flavr Savr टमाटर और रिंगस्पॉट-प्रतिरोधी पपीता के दो कल्टिवार को शामिल करते हुए पूर्ववर्ती व्यापारिक उत्पादों का मौलिक रूप से विकास एंटिसेंस तकनीक का प्रयोग कर किया गया लेकिन संभवत: आरएनएआई मार्ग का शोषण किया गया।[१२९][१३०]
इतिहास और खोज

आरएनएआई की खोज पहली बार ट्रांस्जेनिक पौधों में अभिव्यक्त एंटिसेंस अरएनए द्वारा ट्रांस्क्रिप्शनल अवरोध का अवलोकन कर[१३२] और 1990 के दशक में अमेरिका और नीदरलैंड्स के वौज्ञानिकों द्वारा किए गए प्रयोग के अनपेक्षित परिणामों की रिर्पोर्ट के द्वारा अधिक सीधे ढंग से किया गया।[१३३] संध्या मालती में रंग को बदलने के एक प्रयास में शोधकर्ता एक जीन इनकोडिंग कैलकोन सिन्थेज, सामान्यत: गुलाबी और बैंगनी फूल के रंगो की संध्या मालती के पौधों के फूल के पिगमेंटेशन के लिए एक कुंजी एंजाइम, की एक अतिरिक्त प्रति को सामने लाए. अतिअभिव्यक्त जीन से अधिक गहरे फूल के परिणाम की आशा की गई, लेकिन उसने कम पिगमेंट किए हुए आधे सफेद फूलों को पैदा किया, यह संकेत देते हुए कि कैलकोन सिन्थेज की सक्रियता काफी हद तक घट चुकी थी; वास्तव में, एंडोजेमस जीन और ट्रांसजीन दोनों सफेद फूलों में डाउनरेगुलेट हो गए। तुरंत बाद, एक संबंधित घटना क्वेलिंग को फंगस न्युरोस्पोरा क्रासा में दर्ज किया गया, हलांकि उसे संबंधित होने के रूप में तुरंत नहीं पहचाना गया।[१३४] पौधों में फिनोमेनॉन के आगे की खोज ने यह संकेत दिया कि डाउनरेगुलेशन mRNA क्षरण के बढ़े हुए दर के माध्यम से जीन अभिव्यक्ति के परा-अवरोध के कारण हुआ।[१३५] इस घटना को जीन अभिव्यक्ति का सह-दमन कहा गया, लेकिन आणविक प्रणाली अनजान बनी रही। [१३६]
इसके तुरंत बाद ही वायरल रोगों से पौधों के बचाव को सुधारने के लिए काम कर रहे विषाणुविदों ने एक समान घटना का अवलोकन किया। जबकि यह ज्ञात था कि वायरस-विशेष प्रटीन को अभिव्यक्त कर रहे पौधों ने वायरल संक्रमण के प्रति प्रतिरोध या सहिष्णुता दिखायी, यह अनपेक्षित था कि वायरल आरएनए अनुक्रम के केवल लघु, गैर-कोडिंग क्षेत्र समान स्तर की सुरक्षा दरसाएंगे. शोधकर्ताओं का मानना था कि ट्रांसजीन द्वारा उत्पादित वायरल आरएनए वारयल प्रतिकृति को रोक सकते हैं।[१३७] इसके विपरीत प्रयोग, जिसमें पादप जीन के लघु अनुक्रम को लागू किया गया, ने यह दिखाया कि एक संक्रमित पौधे में लक्ष्य किए गए जीन को दमित किया गया था। इस घटना का लेबल था, "वायरस-प्ररित जीन सायलेंसिंग (VIGS) और इस तरह की घटना को सामूहिक रूप से पोस्ट ट्रांस्क्रिप्शनल जीन सायलेसिंग कहा जाता था।[१३८]
पौधों में इन प्रारंभिक अवलोकनों के बाद अन्य जीवों में इस घटना की खोज विश्व भर के बहुत सारे प्रयोगशालाओं में की गई।[१३९][१४०] क्रेग सी. मेलो और एंड्रयू फायर के 1998 के नेचर शोध पत्र ने सी.एलेगन्स में डबल स्ट्रेंडेड आरएनए का इंजेक्शन लगाने के बाद एक शक्तिशाली जीन सायलेंसिंग होने की सूचना दी.[२] मांशपेशियों के प्रोटीन के उत्पादन की खोज में उन्होंने यह अवलोकन किया कि न तो mRNA और ना ही एंटिसेंस आरएनए इंजेक्शन का प्रोटीन उत्पादन पर कोई प्रभाव था, लेकिन डबल-स्ट्रेंडेड आरएनए ने लक्ष्य किए गए जीन को सायलेंस कर दिया. इस काम के परिणाम के बाद उन्होंने RNAi शब्द गढ़ा. फायर और मेलो की खोज विशेष रूप से उल्लेखनीय थी, क्योंकि इसने इस घटना के लिए प्रेरक एजेंट की पहली पहचान का प्रतिनिधित्व किया। 2006 में फायर और मेलो को उनके कार्य के लिए फिजियोलॉजी या चिकित्सा के क्षेत्र में नोबेल पुरस्कार से सम्मानित किया गया।[१]
सन्दर्भ
बाहरी कड़ियाँ
- कैम्ब्रिज विश्वविद्यालय से द नेकेड साइंटिस्ट आरएनएआई (RNAi) अवलोकन की प्रक्रिया.
- प्रकृति से, आरएनएआई (RNAi) प्रक्रिया एनिमेशन
- नोवा (NOVA) साइंसनाओं एक्स्प्लेंस आरएनएआई (RNAi) - नोवा ब्रौडकास्ट जो पीबीएस (PBS) पर है उसमें 15 मिनट का वीडियो प्रसारित. 26 जुलाई 2005
- साँचा:PLoSlink
- साइलेंसिंग जीनोम RNA का हस्तक्षेप और शाही सेना हस्तक्षेप (आरएनएआई) प्रयोगों और शिक्षा के लिए सी. एलेगंस में जैव सूचना. कोल्ड स्प्रिंग हार्बर प्रयोगशाला के अध्ययन केंद्र के डोलन डीएनए (DNA).
- सी. एलेगंस में एक 96-अच्छी तरह से तरल स्वरूप में आरएनएआई (RNAi) स्क्रीन और उनके आनुवंशिक सहभागिताओं की पहचान व्यवस्थित करने के लिए अनुप्रयोग (एक प्रोटोकॉल)
- एनवाई (NY) टाइम्स, से आरएनए के 'वॉर्म पीपल' के लिए नोबल 2 अमेरिकी'
- थेराप्युटिक प्रक्रिया के रूप में RNAi में मुफ्त लेखों का एक संग्रह मोलिक्यूलर थेरपी वेब फोकस: "द डेवलपमेंट ऑफ़ RNAi ऐज़ अ थेराप्युटिक स्ट्रेटेजी",
- ↑ अ आ इ ई उ साँचा:cite web
- ↑ अ आ साँचा:cite journal
- ↑ [4]
- ↑ साँचा:cite journal
- ↑ साँचा:cite journal
- ↑ साँचा:cite journal
- ↑ साँचा:cite journal
- ↑ साँचा:cite journal
- ↑ साँचा:cite journal
- ↑ अ आ इ साँचा:cite journal
- ↑ साँचा:cite journal
- ↑ अ आ साँचा:cite journal
- ↑ साँचा:cite journal
- ↑ साँचा:cite journal
- ↑ साँचा:cite journal
- ↑ साँचा:cite journal
- ↑ साँचा:cite journal
- ↑ साँचा:cite journal
- ↑ साँचा:cite journal
- ↑ साँचा:cite journal
- ↑ साँचा:cite journal
- ↑ साँचा:cite journal
- ↑ साँचा:cite journal
- ↑ अ आ साँचा:cite book
- ↑ साँचा:cite journal
- ↑ साँचा:cite journal
- ↑ साँचा:cite journal
- ↑ साँचा:cite journal
- ↑ साँचा:cite journal
- ↑ साँचा:cite journal
- ↑ साँचा:cite journal
- ↑ साँचा:cite journal
- ↑ साँचा:cite journal
- ↑ साँचा:cite journal
- ↑ साँचा:cite journal
- ↑ [73]
- ↑ साँचा:cite journal
- ↑ साँचा:cite journal
- ↑ साँचा:cite journal
- ↑ साँचा:cite journal
- ↑ अ आ इ ली एलसी, ओकिनो एसटी, जहो एच, पूकोट डी, प्लेस आरऍफ़, युराकमी एस, एन्कोइदा एच, दहिया आर. (2006). छोटे डीएसआरएनएएस (dsRNAs) मानव कोशिकाओं में ट्रांसक्रिप्शनल सक्रियण प्रेरित. प्रोक नटल एकैड विज्ञान संयुक्त राज्य अमेरिका (USA) 103(46):17337-42. PMID 17085592 सन्दर्भ त्रुटि:
<ref>अमान्य टैग है; "Li" नाम कई बार विभिन्न सामग्रियों में परिभाषित हो चुका है सन्दर्भ त्रुटि:<ref>अमान्य टैग है; "Li" नाम कई बार विभिन्न सामग्रियों में परिभाषित हो चुका है - ↑ साँचा:cite journal
- ↑ साँचा:cite journal
- ↑ साँचा:cite journal
- ↑ साँचा:cite journal
- ↑ साँचा:cite journal
- ↑ अ आ साँचा:cite journal
- ↑ साँचा:cite journal
- ↑ साँचा:cite journal
- ↑ साँचा:cite journal
- ↑ अ आ इ [104]
- ↑ साँचा:cite journal
- ↑ साँचा:cite journal
- ↑ साँचा:cite journal
- ↑ साँचा:cite journal
- ↑ साँचा:cite journal
- ↑ साँचा:cite journal
- ↑ साँचा:cite journal
- ↑ साँचा:cite journal
- ↑ साँचा:cite journal
- ↑ साँचा:cite journal
- ↑ साँचा:cite journal
- ↑ साँचा:cite journal
- ↑ साँचा:cite journal
- ↑ अ आ साँचा:cite journal
- ↑ साँचा:cite journal
- ↑ साँचा:cite journal
- ↑ साँचा:cite journal
- ↑ साँचा:cite journal
- ↑ साँचा:cite journal
- ↑ साँचा:cite journal
- ↑ साँचा:cite journal
- ↑ साँचा:cite journal
- ↑ साँचा:cite journal
- ↑ साँचा:cite journal
- ↑ साँचा:cite journal
- ↑ साँचा:cite journal
- ↑ साँचा:cite journal
- ↑ साँचा:cite journal
- ↑ साँचा:cite journal
- ↑ अ आ इ साँचा:cite journal
- ↑ साँचा:cite journal
- ↑ साँचा:cite journal
- ↑ साँचा:cite journal
- ↑ साँचा:cite journal
- ↑ साँचा:cite journal
- ↑ साँचा:cite journal
- ↑ साँचा:cite journal
- ↑ साँचा:cite journal
- ↑ साँचा:cite journal
- ↑ साँचा:cite journal
- ↑ साँचा:cite journal
- ↑ साँचा:cite journal
- ↑ [207]
- ↑ साँचा:cite journal
- ↑ साँचा:cite journal
- ↑ साँचा:cite journal
- ↑ साँचा:cite journal
- ↑ साँचा:cite journal
- ↑ साँचा:cite journal
- ↑ साँचा:cite journal
- ↑ साँचा:cite journal
- ↑ साँचा:cite journal
- ↑ साँचा:cite journal
- ↑ साँचा:cite journal
- ↑ साँचा:cite journal
- ↑ साँचा:cite journal
- ↑ साँचा:cite journal
- ↑ साँचा:cite journal
- ↑ साँचा:cite journal
- ↑ साँचा:cite journal
- ↑ साँचा:cite journal
- ↑ साँचा:cite journal
- ↑ साँचा:cite journal
- ↑ साँचा:cite journal
- ↑ साँचा:cite journal
- ↑ साँचा:cite journal
- ↑ साँचा:cite journal
- ↑ साँचा:cite journal
- ↑ साँचा:cite journal
- ↑ साँचा:cite book
- ↑ साँचा:cite journal
- ↑ साँचा:cite journal
- ↑ साँचा:cite journal
- ↑ साँचा:cite journal
- ↑ साँचा:cite journal
- ↑ साँचा:cite journal
- ↑ साँचा:cite journal
- ↑ साँचा:cite journal
- ↑ साँचा:cite journal
- ↑ [285]
- ↑ साँचा:cite journal
- ↑ साँचा:cite journal
- ↑ साँचा:cite journal
- ↑ साँचा:cite journal
- ↑ साँचा:cite book
- ↑ साँचा:cite journal
- ↑ साँचा:cite journal
- ↑ साँचा:cite journal
- ↑ साँचा:cite journal



